大肠杆菌表达体系因其表达量高、周期短、成本低等诸多优势特征而被广泛用作重组异源蛋白质的表达宿主。据统计超过30%的重组蛋白质药物和50%重组蛋白质的制备是使用大肠杆菌作为表达宿主。蛋白质错误折叠或未折叠以及包涵体形成是大肠杆菌表达体系更广泛应用的主要阻碍。因此,重组蛋白质在大肠杆菌体系中可溶性表达策略探索意义重大。
尽管大肠杆菌表达体系有许多优点,但是在实际应用中也仍然存在一些不足之处,主要包括:(1)缺乏翻译后修饰。相较于真核表达体系,原核表达系统最大的局限性之一在于其缺乏类似于真核生物翻译后修饰的能力,如糖基化修饰、二硫键氧化形成等。这些修饰与重组蛋白质的可溶性、稳定性及生物活性密切有关。(2)无辅助蛋白质折叠机制。原核表达体系缺乏辅助蛋白质折叠机制,重组蛋白质在原核表达体系表达过程中通常以一种自发折叠的方式形成特定结构,对于部分结构复杂、疏水性强的蛋白质易于导致错误折叠,最终形成无活性的包涵体(IBs)。据估计,大约只有30%异源蛋白质可以在大肠杆菌中以可溶性形式表达,其余以包涵体的不溶性聚集物表达,或在细胞提取物中无法检测到,是蛋白质生产和纯化过程中不可忽视的瓶颈,所以通过优化表达策略,改善异源蛋白质在原核表达体系中的可溶性表达也是目前研究的焦点。
那么,重组蛋白质在大肠杆菌中通过哪些途径形成包涵体的呢?
自身氨基酸组成:重组蛋白质氨基酸组成中含硫氨基酸及脯氨酸的数量和比例能够显著影响重组蛋白质在大肠杆菌中的表达形式,含量越高,重组蛋白质更容易形成包涵体。
亲疏水性强弱:从本质上讲,蛋白质的折叠过程在一定程度上是由疏水相互作用驱动的,同时蛋白质的聚集过程极大程度是分子间疏水作用的结果。蛋白质自身疏水性越强,分子间更容易因疏水作用引发聚集,使蛋白质错误折叠的概率越大。
蛋白质合成速度:与真核表达系统不同,大肠杆菌的转录和翻译是快速且紧密耦合的,而快速的蛋白质合成速度对具有复杂结构蛋白质的折叠却是致命的。由于许多真核生物蛋白质需要更长时间和/或折叠伴侣的帮助才能折叠成它们的天然状态,蛋白质合成速率提高一方面通常会导致没有足够时间进行正确的结构折叠,另一方面蛋白质过快合成使重组蛋白质折叠前体快速积累致使缺乏足够的折叠空间极大程度上增加了重组蛋白质之间的相互作用,形成蛋白质聚核,促使并加速更多蛋白质聚集,聚集部分折叠、未折叠或错误折叠的不溶性蛋白质。
重组蛋白质分子大小及结构复杂程度:大肠杆菌的平均蛋白质长度为317个残基,而人类的平均蛋白质长度为510个残基。重组蛋白质分子越大,结构往往越复杂,其所涉及的结构域通常越多,在蛋白质折叠过程中需要克服的分子势能壁垒就越多,其折叠成为准确结构的概率就越低。因此分子结构更复杂、尺寸更大的蛋白质在大肠杆菌系中的表达常伴随着因未能及时正确折叠或本身疏水性结构异常暴露而聚集形成包涵体的风险就会越高。
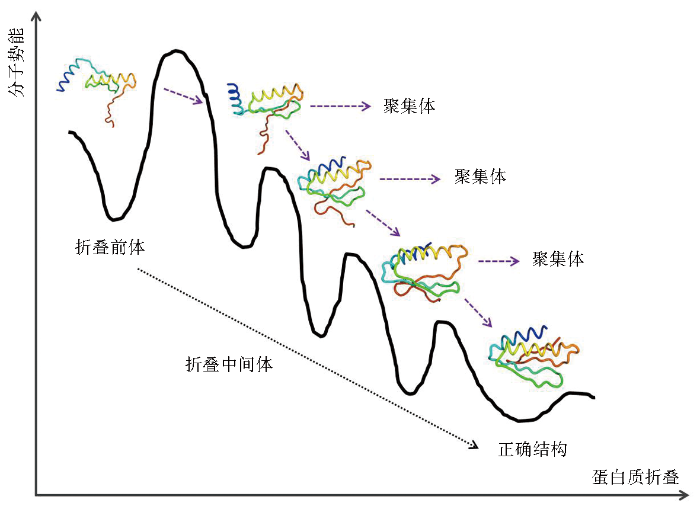
结构折叠难易程度:重组蛋白质中高级结构类型,特别是二级结构的组成比例能够显著影响蛋白质的折叠速度。有研究表明α螺旋结构的折叠速度相比于β发夹结构的折叠速度快近30倍。
二硫键形成与否及数量:蛋白质中的二硫键由两个半胱氨酸残基的硫原子共价连接形成,对蛋白质正确折叠、结构刚性、热力学稳定性和生物活性至关重要。在大肠杆菌中表达含有二硫键的重组蛋白质,往往容易因为其天然刚性结构难以形成而导致重组蛋白质间互相交联在一起,形成不溶性的无活性聚集体,这种情况即使重组蛋白质分泌至周质中,通常也难以氧化形成正确的空间结构,需要借助二硫键氧化酶或分子伴侣才能得以完成。
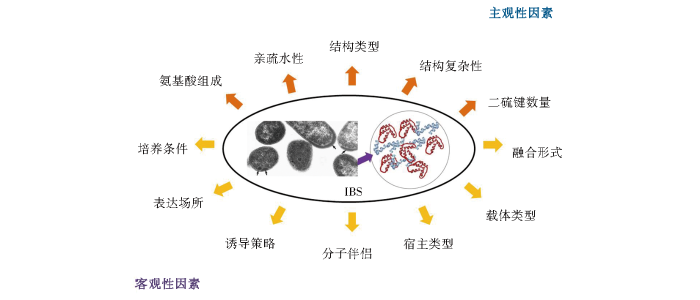
可溶性和功能性蛋白质的制备获取是生物工业应用的主要目标之一,自然途径难以获得令人满意的产量,通过原核表达体系制备高效、低成本的功能性重组蛋白质成为越来越广泛的选择。影响重组蛋白质在大肠杆菌体系中表达形式及表达水平的因素很多,可分为主观性因素和客观性因素。主观性因素包括蛋白质自身结构、氨基酸组成、亲疏水性及二硫键数量等,客观性因素包括表达场所、分子伴侣(融合/非融合)、宿主类型、诱导策略、载体类型等。改善或提高重组蛋白质在大肠杆菌体系中可溶性表达的策略主要针对以上主客观因素进行优化。
密码子偏好性优化:参与蛋白质翻译过程中氨基酸识别与转运的密码子组成具有简并性和物种偏好性。密码子偏好性对重组蛋白质在大肠杆菌表达体系中的表达有着直接影响,蛋白质的正确折叠依赖于基因的顺畅表达,如含有大量单个或少量串列稀有密码子(包括AGA、AGG、AUA、CCG、CCT、CTC、CGA和GTC等)的目的基因在大肠杆菌中更容易出现翻译限速,甚至停滞的现象,导致蛋白质折叠错误。因此,重组蛋白质目的基因密码子的偏好性优化对提高重组蛋白质在大肠杆菌表达体系中的高水平表达具有重要意义。
重组蛋白质诱导表达温度优化:温度对大肠杆菌生长、质粒稳定性、重组蛋白质表达速度及蛋白质折叠效率等有显著影响。大肠杆菌的最佳培养温度一般为37℃,此温度可能并不总是有利于目的基因在大肠杆菌中表达。在较低温度下,细菌生命代谢速度减慢,降低转录、翻译速度,较慢的翻译速率有利于蛋白质正确折叠,同时温度降低时聚集作用也得以减弱,有利于蛋白质折叠和提高重组蛋白质可溶性表达比例。
表达载体选择与优化:表达载体通常包括复制子、筛选标记基因、启动子及转录终止子等元件,大肠杆菌的常用表达载体包括pET系列、pCold系列、pBV系列和pGEX系列等。不同载体之间包含的元件类型和数量具有明显差异。载体的启动子类型对目的基因表达水平和表达方式(可溶或不可溶)的影响非常显著。常见大肠杆菌表达体系的启动子类型包括来源于细菌的lac、tac、trp、araBAD启动子,以及来源于噬菌体的T7、T5、SP6启动子。pET表达载体因其具有T7强启动子而获得较高表达量,是最常使用的启动子类型。
诱导策略及优化:异丙基β-d-1-硫代吡喃半乳糖苷(IPTG)是原核表达体系最常用的重组蛋白质表达诱导剂之一。通过调节IPTG浓度来调控重组蛋白质的表达速度,促进蛋白质可溶性表达,建议在10μmol/L以下浓度范围内优化;在大肠杆菌乳糖操纵子表达系统中,无须额外加入IPTG诱导剂的自动诱导表达策略也是常见的更加温和的诱导方式;热诱导不用添加外来诱导物,成本低,但是发酵过程中加热升温培养,细菌的生长和代谢均加速,在一定程度上加快了重组蛋白质的翻译合成速度,增加蛋白质折叠负担;因此可以尝试在诱导时将培养温度升高至42℃后维持15~30 min,让cIts857蛋白充分变构失活,解除阻遏,启动转录,然后再将培养温度降低至35℃以下,降低细菌的新陈代谢和重组蛋白质表达速度,减轻蛋白质折叠负担;低温诱导能够降低大肠杆菌的新陈代谢,进而降低重组蛋白质合成速度,降低有聚集倾向的重组蛋白质折叠前体累积,一定程度上减少包涵体形成的概率和提高可溶性表达比例。
大肠杆菌表达宿主选择:为了提高蛋白质表达水平,促进二硫键形成,提高蛋白质正确折叠,改善蛋白质可溶性表达比例,各种类型的大肠杆菌宿主细胞被设计与改造。常见的大肠杆菌宿主包括E. coli BL21系列、Rosetta系列和Origami系列等。
表 大肠杆菌表达体系常用宿主亚型类型 Commonly used commercial available E. coli host bacteria
| 大肠杆菌 宿主类型 |
功能应用 | 特征 | 抗性特征 |
| BL21 | 常规表达 | 非毒性蛋白的高水平表达,不能用于由T7启动子驱动的蛋白质表达 | 无 |
| BL21(DE3) | 含T7 RNA聚合酶,可用于T7、lac、tac、trc及trp启动子控制的目的基因表达 | 无 | |
| BL21Star(DE3) | RNase E基因突变失活,防止转录后mRNA的快速降解 | 无 | |
| BL21(DE3) plysS | 毒性蛋白表达,稀有密码子基因表达 | 含有表达T7溶菌酶的基因,可降低目的基因的背景表达水平,但不干扰目的蛋白表达 | 氯霉素 |
| Rossatta (DE3) | 含6种稀有密码子质粒(AUA、AGG、AGA、CUA、CCC、GGA),适合含稀有密码子基因表达 | 四环素、卡那霉素 | |
| BL21 Origami B (DE3) | 含二硫键蛋白表达 | 有助于含二硫键蛋白的活性蛋白质形成 | 四环素、卡那霉素 |
| Origami 2 (DE3) | 在trxB和gor基因上同时含有突变,利于含二硫键蛋白的折叠与氧化 | 四环素、链霉素、卡那霉素 | |
| BL21 trxB (DE3) | 拥有硫氧还蛋白还原酶突变体,利于二硫键在细胞质中形成,适合含二硫键蛋白的正确折叠和表达 | 卡那霉素 | |
| Rosetta-gami (DE3) pLysS | 二硫键氧化,稀有密码子表达 | TrxB和Gor基因突变,利于含二硫键蛋白质正确折叠,同时含有稀有密码子tRNA | 氯霉素、卡那霉素、链霉素、四环素 |
| Rosetta-gami 2(DE3) | 携带有TrxB和Gor基因突变,利于含二硫键蛋白质正确折叠,同时含有稀有密码子tRNA | 四环素 |
胞内表达与分泌表达:通常情况下,大肠杆菌表达重组异源蛋白质采用胞内形式表达,具有表达量高的优势,但是大肠杆菌高还原性及缺乏折叠伴侣分子的胞内环境导致部分蛋白质在胞内表达时易形成包涵体。此种情况下,还可以考虑分泌表达。
细菌培养条件优化:大肠杆菌的培养环境也是影响外源蛋白质可溶性表达的关键因素之一,这些因素包括温度、pH、微量元素等。温度对细菌生长和重组蛋白质表达的影响是多方面的,包括细菌的生长速度、蛋白质合成速度、重组蛋白质折叠前体的聚集倾向程度、蛋白质稳定性和生物活性,以及重组蛋白质的溶解度等。综合效益来看,降低温度往往更有利于重组蛋白质的可溶性表达。因此从培养条件的角度,优化培养温度对提高蛋白质比例影响最大。pH也是影响蛋白质表达形成的因素之一,大肠杆菌生长的最适pH在6.5~7.5,与外源蛋白质等电点相差越大,所表达的蛋白质就更容易形成可溶性蛋白质。因此需要根据菌体和目的蛋白的特点选择合适的pH,并保持培养基中pH 相对稳定。微量元素也能够影响蛋白质的表达形式。研究表明向培养基中加入微量元素(Zn2+、Mg2+等)可以提高目的蛋白的可溶性表达。这可能是因为异源蛋白质二硫键的形成是一个酶依赖性反应过程,向培养基中添加适量金属离子,能够在一定程度上提高部分酶的活性,进而促进重组蛋白质折叠与稳定性。
促溶标签融合表达:促溶标签融合表达在增加重组蛋白质产率及提高可溶性表达比例等方面具有重要应用意义。常用促溶标签包括麦芽糖结合蛋白(MBP)、谷胱甘肽S-转移酶(GST)、小泛素样修饰蛋白(SUMO)和硫氧还蛋白(Trx)等。
表 重组蛋白质表达常用融合标签类型Commonly used solubility-enhancing tags
| 融合标签 | 大小/aa | 功能 | 特征 |
| MBP (Maltose-binding protein) | 396 | 防止聚集沉淀 | 极强促溶 |
| NusA (N-utilization substance) | 495 | 辅助折叠 | 促溶 |
| Trx (Thioredoxin) | 109 | 辅助二硫键氧化 | 改善胞内还原性 |
| SUMO (Small ubiquitin modifier) | 约100 | 促溶、辅助折叠 | 特异性蛋白酶识别(Ulp-1) |
| GST (Glutathione-S-transferase) | 211 | 促溶表达 | 形成二聚体 |
分子伴侣共表达:通过分子伴侣协助重组蛋白质折叠提升重组蛋白质可溶性表达的方式主要为将分子伴侣基因协同插入在表达载体上,使其与目的基因共表达,应用中常见的策略有单种分子伴侣过表达和多种伴侣系统协同过表达。
表 大肠杆菌表达体系常用分子伴侣Commonly used chaperone family member in E. coli
| 分子伴侣家族 | 大肠杆菌体系 对应家族 |
功能 | 应用 |
| HSP60 | GroEL GroES |
高度协调和对称变构辅助蛋白质折叠 | GroEL |
| GroES | |||
| GroEL-GroES(ELS) | |||
| HSP70 | DnaK DnaJ/GrpE |
减少错误折叠蛋白质的聚集并促进蛋白质水解;稳定未折叠蛋白质 | DnaK |
| DnaJ | |||
| DnaK-DnaJ | |||
| DnaK-DnaJ-GrpE(KJE) | |||
| HSP90 | HptG | 减少错误折叠或未折叠蛋白质的聚集 | HptG |
| HSP100 | ClpA ClpB |
拆分含有错误折叠蛋白质的聚集体 | ClpA |
| ClpB | |||
| sHSP | IbpA IbpB |
保护热变性蛋白质不发生不可逆聚集;结合并稳定变性蛋白质 | IbpAB |
| Trigger factor | Trigger factor | 核糖体相关伴侣 | TF |
大肠杆菌N-糖基化修饰:重组异源蛋白质在大肠杆菌中难以可溶性表达的主要因素之一在于缺乏翻译后修饰功能,其中糖基化修饰对重组异源蛋白质的稳定性和溶解性具有极大影响。在一定程度上,缺乏糖基化修饰是影响真核蛋白在大肠杆菌中可溶性表达的最主要因素。
蛋白质错误折叠或未折叠以及形成包涵体是大肠杆菌表达体系应用的巨大阻碍。因此,探索可溶性表达策略对应用大肠杆菌体系生产重组蛋白质意义重大。重组蛋白质自身的氨基酸组成、亲疏水性强弱、分子量大小、结构复杂程度、结构折叠难易程度、二硫键形成与否、二硫键数量及重组蛋白质的合成速度等均能影响重组蛋白质在大肠杆菌表达体系中的表达形式和可溶性表达比例。因此,在大肠杆菌表达体系中实现更多重组异源蛋白质的可溶性与功能性表达仍然有诸多挑战,未来还将从以下几个方面持续改进:其一,不断完善重组异源蛋白质在胞内的结构折叠辅助体系,包括分子伴侣、融合伴侣等的设计与开发;其二,进一步优化提高在原核宿主系统中的二硫键氧化与正确形成能力;其三,持续改善大肠杆菌表达体系的糖基化能力和形式,包括糖基化效率和糖基化糖型优化等。
参考文献:
- Narciandi R E , Rivera J M ,D. Rodríguez.Effect of induction strategy on the expression of different recombinant protein synthesized in Escherichia coli under the control of tryptophan promoter[J]. 2016.
- Thomas J G, Ayling A, Baneyx F.Molecular chaperones, folding catalysts, and the recovery of active recombinant proteins from E. coli Applied Biochemistry and Biotechnology, 1997, 66(3): 197-238.
- de Marco A, Deuerling E, Mogk A, et al.Chaperone-based procedure to increase yields of soluble recombinant proteins produced in E. coli BMC Biotechnology, 2007, 7: 32-32.
- MIAO Zhao-yue, DU Le, WANG Jia-qi, CHEN Zi-jie, HUANG Jing-bei, CHEN Qie-xin, ZOU Pei-xuan, HAN Xiao, ZHANG Chun. Soluble Expression Strategies for Production of Recombinant Proteins in Escherichia coli. Journal of Chinese Biotechnology, 2023, 43(9): 33-45 doi:10.13523/j.cb.2305048

 联系我们
联系我们





