糖基化修饰在药物蛋白功能、稳定性及血浆半衰期等方面起到重要作用。真核生物中糖基化修饰蛋白在维持蛋白稳定、细胞信号转导、免疫调控、细胞间的互作、细菌-宿主识别互作等过程中发挥着重要功能。
N-糖基化修饰是蛋白糖修饰的主要方式之一,寡糖通过与新生肽链中特定天冬酰胺的酰胺氮连接。在原核生物中也广泛存在寡糖合成途径与 N-糖基化修饰蛋白质机制,形成病原菌外膜上的脂寡糖。脂寡糖在病原菌黏附和宿主细胞侵入、逃避宿主免疫防御中发挥重要作用。
大肠埃希菌是人体不可缺少单细胞生物。大肠埃希菌,俗名大肠杆菌(革兰氏阴性短杆菌),周身鞭毛,能运动,无芽。是人和动物肠道中的正常栖居菌。
2002 年,瑞士联邦理工学院Wacker 等研究人员首次将空肠弯曲杆菌( Campylobacter jejuni) N-糖基化基因簇( pgl) 转入大肠杆菌,成功地在大肠杆菌工程菌株中N-糖基化修饰外源蛋白质,开创了利用大肠杆菌 N-糖基化修饰重组蛋白新纪元。近 20 年间,人们利用不同来源的糖基化转移酶、寡糖转移酶,在大肠杆菌中开展类人源和人源化 N-糖基化重组蛋白、病原菌寡糖的糖疫苗制备研究。
利用大肠杆菌表达系统制备N-糖基化重组蛋白的机制
天然原核生物 N-糖基化修饰系统主要由4个必要元件组成:糖基化识别序列、糖基转移酶
(glycosyl transferase,GT) 、糖苷酶、糖底物供体,它们分别负责接受、添加、修剪和提供底物以合成寡糖,并进一步通过依赖寡糖转移酶( oligosaccharyl transferase,OST) /非依赖 OST的途径将寡糖转移到靶蛋白上。将以上机制转移到大肠杆菌中,实现 N-糖基化重组蛋白,可重塑合成寡糖链及重组蛋白修饰,将在糖疫苗生产、糖基化修饰药物蛋白等方面具有巨大应用潜力。
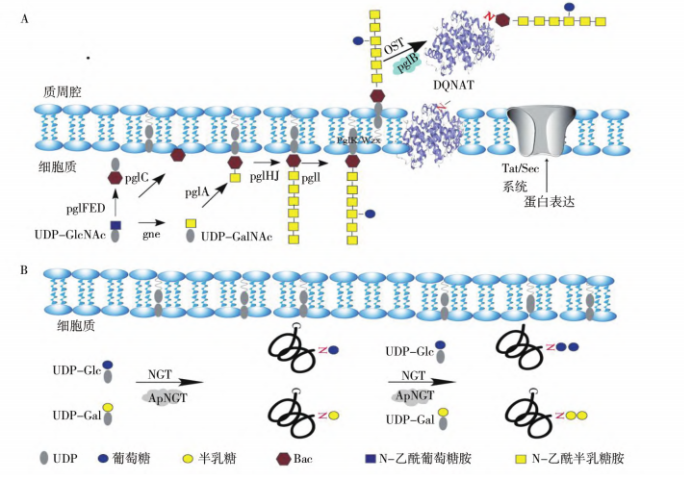
Schematic diagram of the main mechanism of N-glycosylated recombinant protein production via Escherichia coli
A: OST-dependent N-glycosylation system; B: OST-independent N-glycosylation system
应用大肠杆菌表达系统制备N-糖基化重组蛋白
利用大肠杆菌表达系统生产糖基化基因工程抗体等重组蛋白及糖疫苗是目前热点研究方向。自2012 年Aebi课题组首次利用大肠杆菌实现类人源化糖链Man3GlcNAc2核心五糖 N-糖基化修饰重组蛋白后,利用多种原核生物进行糖基化修饰的技术一直在不断探索中,其技术核心是将其他原核生物来源的寡糖转移酶(识别并将寡糖转移到重组蛋白上的糖基化识别序列上)和多种糖基转移酶(非模板驱动合成寡糖)在大肠杆菌中共表达,完成寡糖合成及 N-糖基化定点修饰蛋白基本过程。
近几年研究结果表明该系统可以实现定点(识别特异氨基酸序列)、均质性(糖链微观均质、糖蛋白宏观均质)修饰重组蛋白,这是真核系统无法比拟的优势。真核细胞合成的聚糖性质较其他合成途径而言与人的更为相似(如图)。但是,天然真核细胞表达系统糖表位修饰N-糖基化重组蛋白的均质性很低,这种异质性源于哺乳动物复合型N-多糖合成的多步骤过程。
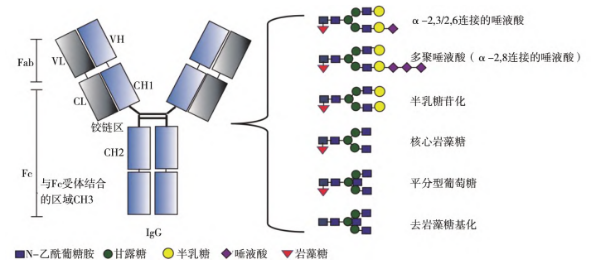
Schematic diagram of antibody glycosylation modification in eukaryotic cells
普健生物拥有十余年的蛋白表达经验,经过不断的探索和改进,开发了建立了3H(High through、High efficiency、High quality)大肠杆菌表达系统,拥有独特的表达纯化及复性平台,95%以上的超高蛋白表达成功率,已成功交付上万例大肠杆菌表达服务项目。如果您有大肠杆菌重组蛋白表达与纯化项目需求,欢迎联系027-87001869与我们的专员进行沟通!
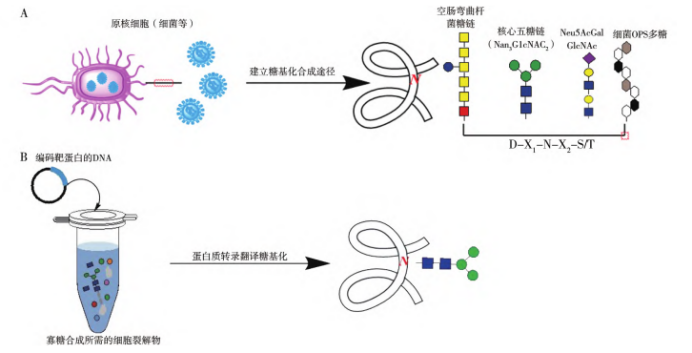
Schematic diagram of the production of N-glycosylated recombinant proteins using Escherichia coli
A: Recombinant protein pathway modified by N-glycosylation in Escherichia coli; B: Cell-free glycoprotein synthesis pathway
O-糖基化修饰可以增加治疗性蛋白的稳定性和体内循环时间。虽然糖基化修饰对每种蛋白质的影响可能不同,但研究显示N-糖基化修饰可通过以下方式改善蛋白的理化性质:
①通过屏蔽非结构化、疏水性或易于蛋白酶作用的蛋白质区域来防止变性、聚集和降解;
②增加分子的分子量和流体动力学半径以减少肾滤过;
③去除免疫原性,减少免疫系统清除;
④覆盖或去除可被人凝集素识别/清除的末端结构。
目前,利用大肠埃希菌解决了均质性修饰N-糖基化修饰重组蛋白问题。该技术有望首先在糖疫苗生产方面得到产业化应用。
参考文献
[1]Wacker M,Linton D,Hitchen PG,et al.N-Linked glycosylation in Campylobacter jejuni and its functional transfer into E.Coli[J].Science,2002,298( 5599) : 1790-1793.
[2]Kightlinger W,Warfel KF,Delisa MP,et al.Synthetic glycobiology: Parts,systems,and applications[J]. ACS Synthetic Biology,2020,9(7) : 1534-1562.
[3]Pratama F,Linton D,Dixon N.Genetic and process engineering strategies for enhanced recombinant N-glycoprotein production in bacteria[J].Microbial Cell Factories,2021,20( 1) : 198.
[4]Terra VS,Mauri M,Sannasiddappa TH,et al.PglB function and glycosylation efficiency is temperature dependent when the pgl locus is integrated in the Escherichia coli chromosome[J].Microbial Cell Factories,2022,21( 1) : 6.
[5]Marshall LE,Nelson M,Davies CH,et al.An O-antigen glycoconjugate vaccine produced using protein glycan coupling technology is protective in an inhalational rat model of tularemia[J].Journal of Immunology Research,2018,2018: 8087916.
[6]Cuccui J,Thomas RM,Moule MG,et al.Exploitation of bacterial N-Linked glycosylation to develop a novel recombinant glycoconjugate vaccine against Francisella tularensis[J].Open Biology,2013,3( 5) : 130002.

 联系我们
联系我们





