相比传统小分子药物,重组蛋白药物具有高活性、高特异性和低毒性等多种独特优势,但囿于机体内蛋白水解、肾脏消除、肝脏代谢以及免疫清除等影响,往往导致重组蛋白药物的体内半衰期短,使用受限。
当药物进入系统时,由各种酶引起的代谢,尤其是多种形式的蛋白水解酶的作用,可导致药物降解为小分子肽或者氨基酸。这类酶广泛存在于胃、肠道,其分布具有细胞组织的特异性。非蛋白酶因素的影响来源于蛋白质物理或化学上的变化。物理变化包括聚合、沉淀;化学变化包括氨基酸残基的修饰,主要有氧化作用、还原作用、脱酰胺反应、水解反应、β消除、二硫化物交换等几种反应,并且蛋白质在构建中的稳定性和免疫原性以及导致蛋白质化学结构错误变化的环境条件也被认为是影响蛋白质代谢稳定性的主要因素。较大的多肽常通过受体介导的方式来清除,有不少例子显示,受体介导的清除可能是一种主要的清除机制。
基于以上的清除机制,延长蛋白半衰期的策略主要分为保护酶解识别位点的结构改造策略、改善蛋白理化性质的天然或人工多聚物修饰策略以及降低免疫原性的碳水化合物修饰策略等。
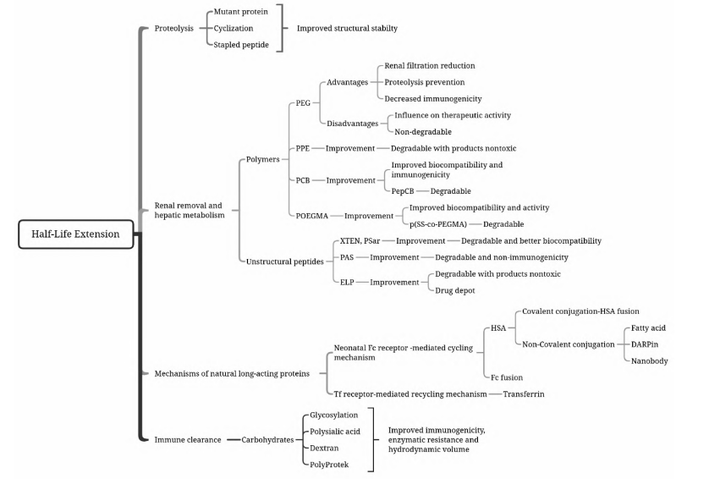
Half-life extension strategies for therapeutic proteins and peptides
普健生物拥有专业的技术团队,在蛋白表达领域有着15年的经验,近20000+重组蛋白表达与纯化经验。为您提供六种高效蛋白表达系统:大肠杆菌表达系统,枯草芽孢杆菌表达系统,酵母表达系统,昆虫表达系统,哺乳表达系统,二硫键活性原核表达系统。普健生物专注于重组蛋白的表达,蛋白可溶性表达成功率在90%以上。如果您有高效长效蛋白表达需求,欢迎联系027-87001869与我们的专员进行沟通!
重组蛋白药物的发展趋势有以下两个特点:
第一,哺乳动物细胞作为表达体系的比例增加。原因在于,原核表达系统(如大肠杆菌E. coli),适合分子量较小、不需要翻译后修饰的非糖基化蛋白(如胰岛素、生长激素、干扰素和白细胞介素等);而哺乳动物细胞表达系统可进行复杂的翻译后修饰(如蛋白质折叠、糖基化和二硫键的形成),表达的蛋白质与天然蛋白质更为接近,且能通过控制翻译后修饰实现预期功效。
第二,长效化重组蛋白的进展较大。利用化学修饰、基因工程技术等对蛋白质药物进行改造或修饰,解决大分子蛋白质药物血液中半衰期短、给药途径单一、免疫原性和毒副反应等问题,增强药物活性、提高药效等,是近年来生物技术药物发展的趋势。长效蛋白质生物制剂技术的研究一直是大分子蛋白质药物的研究热点,国际上许多大公司纷纷开展蛋白质药物长效制剂的开发研究,抢占核心技术的制高点。
重组蛋白药物长效化技术常用化学修饰、突变体构建、蛋白融合、糖基化等策略。化学修饰如聚乙二醇(polyethyleneglycol,PEG)修饰、聚磷酸酯(PPE)修饰、聚羧基甜菜碱(Poly( carboxybetaine),PCB)修饰、多聚唾液酸(Polysialition,PSA)、脂肪酸修饰等。它们通过化学的方法将蛋白质药物与大分子亲水修饰剂进行共价偶联的方法。共价连接到大分子上能减小免疫原性,改善可溶性和生物学利用度,以及增加抗蛋白水解作用,同时也能够延长半衰期。
构建突变体是将蛋白分子一个位点或多个位点进行突变,以期改善蛋白稳定性,提高亲和力或活性,降低免疫原性等,是蛋白药物设计的一个重点方向。
蛋白融合也被认为是天然蛋白修饰,包括Fc融合蛋白和人血清白蛋白融合蛋白。Fc融合蛋白是指利用基因工程等技术将某种具有生物学活性的功能蛋白分子与Fc片段融合而产生的新型蛋白质,功能蛋白可以是能结合内源性受体(或配体)的可溶性配体(或受体)分子或其他需要延长半衰期的活性物质(如细胞因子)。Fc融合蛋白大大增加活性蛋白或多肽的分子量,降低肾小球的滤过率,而FcRn (Neonatal Fc receptor,新生儿Fc受体)介导的再循环机制可以避免蛋白降解,有效延长半衰期。
Fc融合蛋白的发展分为两个阶段:第一阶段,对于小分子肽通过表达二聚体融合蛋白实现延长药物的半衰期(例如礼来糖尿病药物Trulicity);第二阶段,对于分子量大于30 kDa的大分子蛋白使用二聚体Fc和单体蛋白策略。作为目前最为成功的蛋白长效化手段之一,目前已有10多种批准上市的Fc融合蛋白药物。
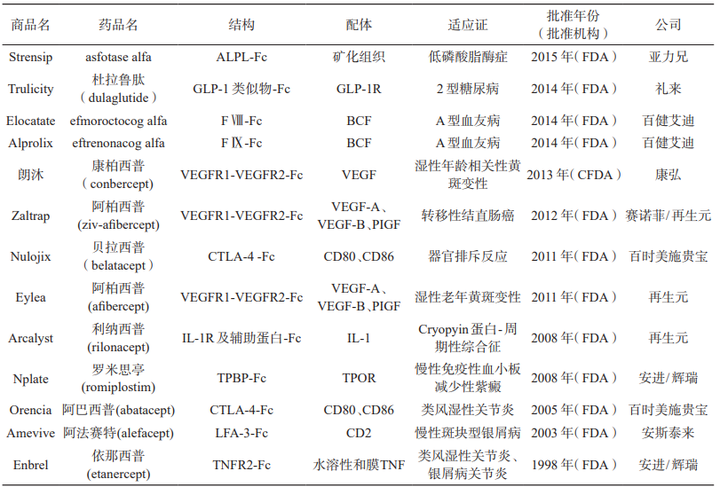
已上市的重组 Fc 融合蛋白类药物
人血清白蛋白( Human serum albumin,HSA) 是血浆中含量最高的蛋白质,相对分子质量66500,半衰期约19 d。作为一种长效的天然蛋白,其长效机制在于HSA在弱酸性的溶酶体( pH6.0) 环境中可通过结构域III结合FcRn,随后通过FcRn的跨膜作用被重新转运至血液,并在中性血液中( pH7.4) 被释放,避免了溶酶体的降解作用。作为天然蛋白,HAS 还具有亲水稳定、安全无毒等优点,药物可以通过基因融合或共价修饰的方式直接结合,也可以通过结合 HSA配体与其非共价结合,因此 HSA 可作为理想的天然修饰物。
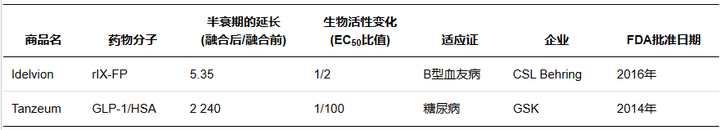
Marketed albumin fusion proteins
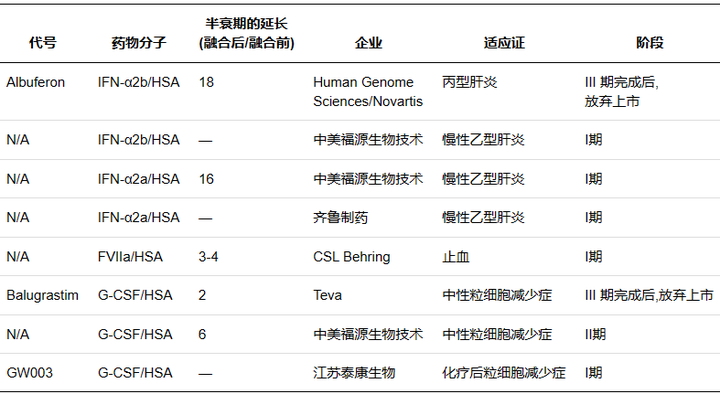
Albumin fusion proteins in clinical development
蛋白质的糖基化(Glycosylation)是真核生物的一种常见翻译后修饰方式,是某些蛋白质发挥生物活性所必需的。蛋白质表面的糖链能够影响蛋白质的药物动力学作用、生物活性、稳定性、对蛋白酶的易感性、水溶性、凝集性、免疫原性等。因此糖基化修饰也是延长半衰期的常用手段。
具体说来,糖基化可分为N-糖基化与O-糖基化。N-糖基化是指聚糖通过糖苷酰胺连接在 Asn-X-Ser/Thr共有序列中Asn残基的侧链上,工程上N-糖基化通常通过引入Asn-X-Ser/Thr序列,增加N-糖基化位点完成。O-糖基化则是聚糖通过O-糖苷键连接到Ser侧链或Thr的羟基上。
需要说明的是,作为典型的翻译后修饰手段,糖基化修饰往往需要通过工程化哺乳动物细胞完成,修饰糖的种类、数量、分子大小、序列和电荷等因素对于药物理化性质和生物活性的影响复杂而特异,并有助于提高药物的靶向性。然而由于糖基化可控性低,因此糖基化药物在应用上仍面临着产率低、控制困难等技术挑战。
参考文献
[1] Haris B,Saraswathi S,Hussain K.Somatostatin analogues for the treatment of hyperinsulinaemic hypoglycaemia[J].Ther Adv Endocrinol Metab,2020,11: 1-23.
[2] Pairawan S,Zhao M,Yuca E,et al.First in class dual MDM2/MDMX inhibitor ALRN-6924 enhances antitumor efficacy of chemotherapy in TP53 wild-type hormone receptor-positive breast cancer models[J].Breast Cancer Res,2021,23( 1) : 23-29.
[3] Zaman R,Islam R,Ibnat N,et al.Current strategies in extending half-lives of therapeutic proteins[J].J Control Release,2019,301: 176-189.
[4] Kinstler OB, Gabriel NE, Farrar CE, et al. N-terminally chemically modified protein compositions and methods: US, 7090835. 2006-08-15.
[5] Ilyushin DG, Smirnov IV, Belogurov AA, et al. Chemical polysialylation of human recombinant butyrylcholinesterase delivers a long-acting bioscavenger for nerve agents in vivo. Proc Natl Acad Sci USA, 2013, 110(4): 1243–1248. DOI: 10.1073/pnas.1211118110
[6] Rogers B,Dong D,Li Z.Recombinant human serum albumin fusion proteins and novel applications in drug delivery and therapy.Curr Pharm Des, 2015,21(14):1899-1907.

 联系我们
联系我们





