肿瘤免疫微环境包括肿瘤细胞、内皮细胞、多种类型的免疫细胞和复杂的细胞外基质等,是肿瘤与免疫相互作用的关键因素。与正常细胞比较,肿瘤细胞通常存在异常的细胞质DNA,其来源主要包括基因组不稳定性形成的包裹染色质片段的微核释放、DNA损伤修复和细胞周期失调引起的胞质内异常dsDNA的积累。此外,氧化应激和线粒体功能障碍也可能导致线粒体DNA泄露到细胞质中。DNA作为一种免疫刺激因子,具有PAMP和DAMP的双重特性,被模式识别受体识别,参与调控微生物感染、自身免疫、炎症、器官退化等多种病理过程。
cGAS-STING通路是识别胞质DNA的重要途径。cGAS可以识别细胞质中游离的dsDNA,其同源二聚体以高亲和力结合不同来源的dsDNA,形成四聚体复合物,并通过液-液相分离促进聚集。cGAS对dsDNA的识别是序列非依赖的,在静息状态下cGAS为自抑制状态,其在结合dsDNA后发生构象变化,激活并催化第二信使cGAMP的合成。cGAMP结合内质网跨膜蛋白STING的细胞质配体结合域,使STING发生构象变化后活化,在COP-Ⅱ和ARF GTP酶等调节蛋白的协助下,从内质网转移到内质网-高尔基体中间体以及高尔基体。STING在转位过程中招募TBK1/IKKε激酶,后者经磷酸化活化后招募IRF3形成经典的STING信号体。随后,磷酸化并二聚化的IRF3进入细胞核,促进Ⅰ型干扰素和大量ISG产生,并协同活化的NF-κB诱导促炎性细胞因子产生。除了介导天然免疫应答之外,cGAS-STING信号的非经典功能也受到了广泛的关注,在细胞衰老、自噬、信使RNA翻译和能量代谢等多种生理过程中具有重要的调控功能。
cGAS-STING通路在肿瘤免疫调控中扮演着重要的角色,是连接天然免疫和适应性免疫的关键桥梁,已成为肿瘤免疫治疗中备受关注的靶点。cGAS-STING通路的下游信号诱导细胞凋亡和细胞周期停滞,从而阻碍了早期肿瘤发展,介导抗原提呈细胞激活以及促炎性细胞因子产生,促进肿瘤免疫循环并重塑肿瘤免疫微环境,并促使树突状细胞、T淋巴细胞、NK细胞等免疫细胞招募和激活,增强了免疫监视以及免疫系统对肿瘤细胞的攻击能力。cGAS-STING通路的细胞间信号传递有多种方式,包括基于膜系统细胞外囊泡运输、膜融合和吞噬作用等,基于膜蛋白介导的转运和缝隙连接等。来自浙江大学生命科学学院、浙江省癌症分子细胞生物学重点实验室、浙江大学杭州国际科创中心智能医药研究所、浙江大学癌症研究院等研究机构的团队成员就肿瘤免疫微环境中cGAS-STING通路如何传递信号、如何调控微环境及其基于膜蛋白的细胞间通信机制等做了深入探讨和解读,为癌症治疗和免疫疗法的发展提供潜在的靶点和全新的策略见解。
cGAS-STING信号通路对肿瘤微环境的调控
在肿瘤中,cGAS-STING通路的作用具有两面性。一方面,STING的激活上调了肿瘤细胞中的多种炎症基因,诱导细胞凋亡和细胞周期停滞,从而阻碍了早期的肿瘤发展。同时,肿瘤来源的dsDNA、cGAMP以及活化的STING蛋白可以通过细胞间转移激活树突状细胞、NK细胞等中的STING信号级联,促进肿瘤免疫循环并重塑肿瘤免疫微环境。此外,STING介导的自噬具有非免疫性抗肿瘤的功能。另一方面,cGAS-STING通路促进一些肿瘤的发生发展,如STING诱导的调节性B细胞限制肿瘤免疫中NK细胞功能,STING上调PD-L1促进宫颈癌进展等。
cGAS-STING基于膜系统的细胞间通信
在肿瘤免疫微环境中,膜介导的细胞间通信是cGAS-STING通路信号在不同类型细胞间传递的重要机制之一,包括细胞外囊泡运输、吞噬作用和细胞膜融合等。这些基于膜系统的细胞间通信能传递dsDNA、cGAMP和活化的STING蛋白等重要的免疫分子,从而加强免疫监视和炎症应答。
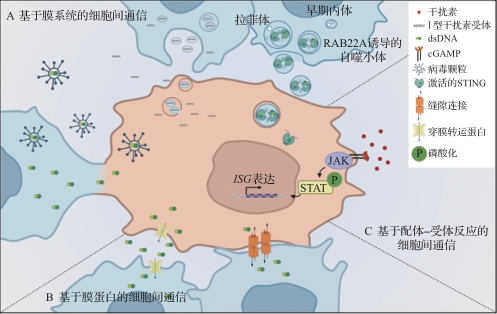
细胞外囊泡是从细胞膜突起产生的脂质双层结构的囊泡小体,可以被细胞释放和捕获,广泛存在于各种体液中,通过自分泌和旁分泌方式参与抗原提呈、细胞迁移和细胞分化等。细胞外囊泡中包裹的功能分子包括蛋白质、脂质、遗传物质、氨基酸和代谢产物等。在肿瘤免疫中,细胞外囊泡对受体细胞的影响主要由其内容物决定,cGAS-STING通路的dsDNA和活化的STING蛋白能通过细胞外囊泡转运至旁观者细胞。
巨噬细胞、树突状细胞和中性粒细胞等免疫细胞通过吞噬作用摄取DAMP,包括凋亡细胞、损伤相关碎片和代谢产物等。肿瘤细胞与免疫细胞之间的dsDNA转移通常通过吞噬作用发生在肿瘤微环境中。免疫细胞感知肿瘤细胞来源的dsDNA,触发cGAS-STING信号的激活,促进抗原提呈以及获得性免疫反应。吞噬作用和膜融合发生均能介导cGAS-STING信号通路在不同类型细胞间传递,这对于免疫系统的协同至关重要。
cGAS-STING基于膜蛋白的细胞间通信
基于膜蛋白的细胞间通信是细胞间实现物质和信号传递的另一种重要机制。这些膜蛋白允许离子、小分子、蛋白质等通过细胞膜或亚细胞膜结构进行传递,从而影响细胞的功能。cGAMP能通过缝隙连接、膜转运蛋白等方式在邻近细胞间传递,而dsDNA能通过膜转运蛋白在邻近细胞间传递,这对免疫调节和炎症反应至关重要。
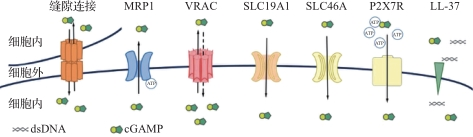
缝隙连接是一种细胞间通道,允许相邻细胞进行离子和小分子的直接交换。cGAMP不能直接穿过细胞膜,其在细胞间的传递需要转运蛋白协助,cGAMP可以通过缝隙连接在两个相邻细胞间自由传递。与缝隙连接不同,基于膜转运蛋白的信号传递涉及出现在细胞外基质中的信号分子,参与调控肿瘤免疫微环境中的细胞外基质,并能将信号分子传递到更远处的受体细胞中。肿瘤细胞死亡会释放大量dsDNA到细胞外基质中,通常这些dsDNA会被DNA酶快速降解,因此失去免疫原性。内源性抗菌肽LL-37是中性粒细胞的重要效应分子,具有广谱杀菌及抗肿瘤活性,能与细胞外基质中的dsDNA形成复合体,介导dsDNA转运到单核细胞中,以Toll样受体非依赖的方式介导Ⅰ型干扰素的产生,调节肿瘤免疫微环境,从而调控NK细胞等免疫细胞的功能。
cGAS-STING基于配体-受体反应的细胞间通信
在肿瘤免疫微环境的调控中,cGAS-STING通路下游的效应因子如干扰素发挥着关键而复杂的作用。干扰素是一类高活性、多功能的分泌型糖蛋白,具有广泛的生物学活性,通过配体-受体反应调节适应性免疫、病原体感染、抗肿瘤免疫应答和炎症反应等。
Ⅰ型和Ⅲ型干扰素是Toll样受体、RIG-Ⅰ样受体和cGAS下游的重要分泌蛋白,其在细胞间的传递主要通过与受体蛋白(如α干扰素受体1和α干扰素受体2)结合,并以旁分泌的方式激活JAK-STAT信号通路。这个基于配体-受体的干扰素信号传递过程促使多个ISG的产生,从而调节和影响免疫应答。干扰素在肿瘤免疫中的作用是多方面的。首先,干扰素能够激活树突状细胞,后者在免疫系统中充当信息传递的枢纽。激活的树突状细胞能够捕获和提呈肿瘤相关抗原,随后激活适应性免疫细胞,干扰素通过增加CD8+ T细胞数和活性来加强免疫系统对于肿瘤的攻击力。
值得注意的是,干扰素也可以通过PD-L1调控免疫监视。PD-L1与T淋巴细胞表面上的PD-1受体相互作用,抑制T淋巴细胞的活性,从而允许肿瘤细胞逃脱免疫攻击。而干扰素通过减少PD-L1的表达,恢复T淋巴细胞的杀伤功能,进一步增强抗肿瘤免疫反应。干扰素在肿瘤免疫中发挥着复杂而关键的作用,其激活了免疫细胞,提高了抗肿瘤免疫反应,同时也有助于克服肿瘤细胞的免疫逃逸策略。因此,研究cGAS-STING通路下游的效应因子如干扰素的细胞间传递对于更好地理解和利用免疫系统来对抗肿瘤具有重要意义。
cGAS-STING通路在增强先天免疫和激活适应性免疫方面具有重要功能,其信号的激活通常有助于提高抗肿瘤免疫,且STING激动剂是极具潜力的肿瘤免疫治疗药物。值得注意的是,cGAS-STING通路不仅在细胞内发挥作用,还可以通过基于膜系统的细胞外囊泡运输、吞噬作用和细胞膜融合,基于蛋白质通道的缝隙连接、膜转运蛋白,以及配体-受体反应等多种途径,作为一种可传递的信号传播到旁观者细胞中。cGAS-STING通路在细胞间的传递扩大了感知PAMP和DAMP的影响范围,增强了天然免疫。
参考文献
Mengqiu WANG1,Pinglong XU,Qirou WU.Cell-to-cell communications of cGAS-STING pathway in tumor immune microenvironment,Journal of Zhejiang University (Medical Sciences) , Volume 53, Issue 1: 15 - 24 (2024)
转载说明:本文图文源自Journal of Zhejiang University Medical Sciences,仅做学术分享使用;感谢每一位作者的辛苦付出与创作,除转载众多无法溯源的文章,我们均在文章中备注了来源。如转载涉及版权等问题,请联系我们删除,非常感谢!

 联系我们
联系我们





