线粒体是由原核生物α-变形菌进化而来的存在于大多数真核细胞中的一种功能多样的细胞器,由线粒体外膜和内膜、线粒体膜间隙、线粒体内膜嵴以及线粒体基质五种不同结构组成。线粒体是真核细胞代谢和合成的中心,也是动物细胞中除细胞核之外唯一携带基因组的细胞器。
mtDNA是一个环状DNA,能编码氧化磷酸化复合物形成所需的13种蛋白质、22种转运RNA和2种线粒体RNA翻译所需的核糖体RNA。作为细胞能量代谢和合成的中心,线粒体通过氧化磷酸化过程产生ATP以维持细胞内能量稳态,同时代谢中间产物则是生物合成途径的重要参与者。此外,线粒体通过释放mtDNA、mtROS和代谢产物等参与调节包括细胞能量代谢、细胞命运决定和免疫反应在内的多种细胞生物学过程。越来越多的研究也表明线粒体功能障碍与包括自身免疫性疾病在内的多种疾病发生有关,而且功能异常的线粒体是细胞恶性转化的驱动力。
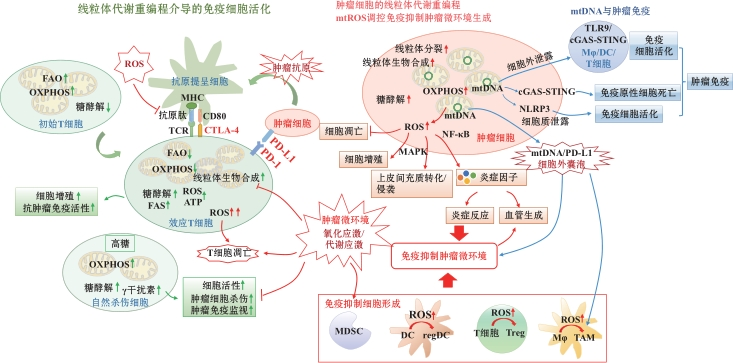
肿瘤微环境中包括肿瘤细胞和免疫细胞在内的多种细胞的线粒体功能异常是癌症发生、发展和转移的重要原因。为此,来自浙江大学生命科学研究院、温州大学生命与环境科学学院等机构的研究人员围绕线粒体生物学与抗肿瘤免疫应答之间的关系阐明了线粒体在肿瘤-宿主互作中的核心作用,为开发靶向线粒体的抗肿瘤免疫治疗策略提供了深入见解。
线粒体调控免疫细胞活化、增殖和分化
不同种类和不同表型的免疫细胞具有特定的代谢需求,其活化状态受到多条信号通路调控。线粒体动力学和能量代谢途径变化在免疫细胞活化、增殖和分化过程中发挥至关重要的作用。初始T细胞的线粒体形态多为碎片化和圆球状,氧化磷酸化和脂肪酸氧化是维持其静止状态下能量需求的主要途径。而当T淋巴细胞被激活时,有氧糖酵解和脂肪酸合成相关信号活性显著增加,从而维持其增殖和分化能力并促进其发挥相应的生物学功能;同时线粒体在T细胞受体簇下方聚集,活化的T细胞受体通过上调钙调磷酸酶活性活化动力蛋白相关蛋白1(Drp1),并诱导线粒体进一步分裂和线粒体内膜嵴松弛以调控效应T细胞活化调控作用。此外,线粒体在T细胞信号转导和细胞命运决定过程中同样发挥重要作用。T淋巴细胞活化过程中,线粒体在T淋巴细胞和抗原提呈细胞形成的免疫突触中积累,T细胞受体活化刺激线粒体生成活性氧和ATP,在维持钙离子稳态和调控其下游相关信号活化中至关重要。而当活化的T细胞向记忆T细胞或调节性T细胞发展时,线粒体则从分裂状态逐渐融合形成长管状结构,线粒体内膜嵴变得紧密,随后细胞代谢状态转向脂肪酸氧化和氧化磷酸化,以维持细胞表型、存活和功能转变。
在肿瘤微环境中,肿瘤浸润性T细胞长期处于高度氧化应激状态,由于葡萄糖和氧气缺乏环境介导的代谢不足和Akt1-PGC1α信号介导的线粒体功能和质量持续损伤,其细胞增殖能力、生物膜结构完整性和相关信号通路活化水平受到严重影响,T淋巴细胞抗肿瘤免疫效应和相关细胞因子产生遭到严重破坏,最终引发免疫抑制和肿瘤免疫逃逸。
在低氧肿瘤微环境中,肿瘤浸润NK细胞的线粒体形态相较于正常NK细胞呈现出显著的碎片化分裂状态,NK细胞活性和肿瘤杀伤能力明显降低并丧失肿瘤免疫监视能力。
线粒体DNA在抗肿瘤免疫中的作用
线粒体基因组突变是癌症突变基因组的重要组成部分,mtDNA功能障碍和基因突变与癌症的发生密切相关。mtDNA作为细胞内常见的DAMP,其断裂和释放也是线粒体功能障碍介导机体炎症发生的关键因素;功能障碍线粒体通过MDV,将线粒体成分挤入细胞外囊泡,对细胞器稳态具有重要的调控作用;氧化的mtDNA通过MDV进入内体-溶酶体途径,并通过外泌体进入细胞外空间,触发多种炎症和抗炎调节途径,从而引发相关免疫反应。
在肿瘤微环境中,mtDNA的细胞外泄露主要由外泌体、微泡和凋亡小体组成的细胞外囊泡所介导,mtDNA能够通过直接接触或者MDV进入细胞外囊泡,随后由囊泡运输进入细胞外空间,在细胞死亡过程中,mtDNA能够通过机械性损伤介导的细胞膜破裂被动释放到细胞外。
当mtDNA完整性、复制和损伤修复异常导致mtDNA泄露时,细胞质定位的DNA识别受体cGAS能迅速识别mtDNA并诱导第二信使2´3´-cGAMP生成,随后2´3´-cGAMP通过激活内质网定位的接头蛋白STING介导下游Ⅰ型干扰素信号通路和相关炎症反应活化。泄露到细胞外的mtDNA还可以通过激活临近免疫细胞的TLR9和cGAS-STING信号参与包括巨噬细胞、树突状细胞和T淋巴细胞在内的多种免疫细胞的极化和功能调控。
此外,caspase依赖的细胞凋亡是一个免疫沉默的过程。在细胞凋亡过程中,线粒体外膜通透化的形成能够诱导细胞自噬并通过内体溶酶体途径清除受损线粒体,从而减弱mtDNA介导的免疫信号响应。通过调控caspase和细胞自噬活性推动由mtDNA-干扰素信号介导的免疫原性细胞死亡可增强宿主抗肿瘤免疫响应。
线粒体活性氧在肿瘤免疫逃逸中的关键调控作用
细胞氧化应激是指细胞由于遭受有害刺激或发生剧烈的代谢改变,细胞内高活性分子如活性氧自由基产生过多,氧化与抗氧化系统失衡,从而导致细胞损伤的过程。线粒体是细胞内最主要的活性氧生成细胞器,通过有氧呼吸中的电子传递链和氧化磷酸化过程产生活性氧。生理条件下,低水平的活性氧作为细胞信号转导的重要调控分子,参与调控基因表达、细胞增殖、分化和应激反应等多种细胞生命活动,但细胞内活性氧水平过高则会造成核质和线粒体DNA、蛋白质和脂质的氧化损伤,并最终导致细胞损伤。相较于正常细胞,肿瘤细胞往往携带更多活性氧,包括促癌基因激活、肿瘤抑制功能丧失、线粒体活性改变和组织炎症在内的多个促肿瘤事件均会导致活性氧过量生成,而活性氧介导的氧化应激反应又会进一步推动炎症、纤维化和肿瘤等疾病的病理进程。活性氧作为肿瘤发生的重要媒介,在肿瘤细胞增殖、迁移和侵袭,以及血管生成、炎症和免疫逃逸等不同方面均有重要调控作用,帮助肿瘤细胞适应严峻的生存环境,且其介导的炎症反应还可以改变肿瘤微环境中免疫细胞组成,影响微环境的免疫抑制性。
线粒体能量代谢和生物合成在免疫细胞的活化过程中发挥关键调控作用,而肿瘤细胞竞争性消耗葡萄糖和肿瘤缺氧微环境则会通过介导线粒体损伤和活性氧大量生成,导致免疫细胞长期处于代谢不足和高氧化应激环境,破坏免疫细胞的活化及其肿瘤免疫监视功能,从而获得肿瘤免疫逃逸功能。靶向mtDNA,将代谢疗法和免疫检查点结合或可成为一种很有前途的癌症治疗策略。
参考文献
Jing LI, Pinglong XU, Shasha CHEN,et al.Research progress on mitochondria regulating tumor immunity.Journal of Zhejiang University (Medical Sciences) , Volume 53, Issue 1: 1 - 14 (2024)
转载说明:本文图文源自Journal of Zhejiang University Medical Sciences,仅做学术分享使用;感谢每一位作者的辛苦付出与创作,除转载众多无法溯源的文章,我们均在文章中备注了来源。如转载涉及版权等问题,请联系我们删除,非常感谢!

 联系我们
联系我们





