活化的T细胞核内因子(Nuclear Factors of activated T cells,NFAT)是一类转录因子家族,最初是在活化的T细胞中作为一种能够结合在人白介素-2(Interleukin-2,IL-2)的启动子上的快速诱导其表达的转录因子而被发现。NFAT在多种动物组织和细胞中广泛表达,是细胞内多条信号转导通路的关键调节点,在免疫系统、神经系统发育、轴突生长以及神经系统疾病中也发挥着重要作用。
NFAT蛋白的基本结构
目前已知的NFAT家族包括5个成员,即NFAT1(又称NFATe2,NFATp),NFAT2(又称NFATc1,NFATc),NFAT3(又称NFATc4),NFAT4(又称NFATc3,NFATx)和NFAT5(又称为tonicity enhancer binding protein,TonEBP)。除了在免疫系统如脾脏、外周淋巴系统广泛表达以外,NFAT蛋白几乎在所有的组织中都有表达但是表达水平存在很大区别,如NFATI在胰腺、睾丸、胎盘,脑部的下丘脑、海马、小脑、嗅球、额叶皮质中有大量表达;NFAT2主要在心血管系统和消化系统中含量较多,肾脏中也有表达;NFAT3的表达更加均衡,还会存在于脂肪组织、心肌、卵巢、脊髓、大脑等区域;NFAT4 则存在于骨骼肌和平滑肌,肺,下丘脑及纹状体中。
NFAT家族发现的十几种NFAT蛋白中,除了非保守的C端以外,都具有2个相邻的非常保守的区域,即NFAT同源区(NFAT homology region,NHR),主要与NFAT的转录调节有关;Rel同源结构域( Rel-homology domain,RHD)主要参与NFAT 与 DNA 的结合。
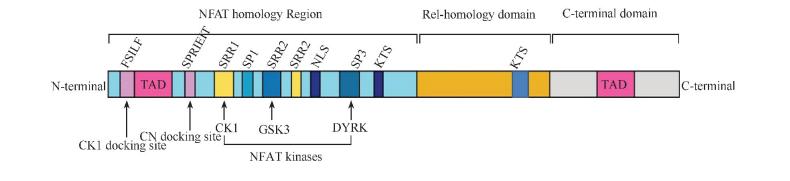
NFAT转录活性的主要调节方式是磷酸化/去磷酸化。NHR中含有多个保守的结构单元,如富含丝氨酸的结构SRR1和SRR2(serine-rich region,SRRs)和富含丝氨酸脯氨酸的结构SP1、SP2和SP3(serine-proline region,SPs),这些结构都能够被NFAT的激酶磷酸化,如酪蛋白激酶(casein kinase 1,CK1),糖原合成激酶3(glycogen synthase kinase 3,GSK-3)和酪氨酸磷酸化调节激酶(dual-specificity tyrosine-phosphorylation-regulated kinase,DYRK)等。
NHR中还含有钙调神经磷酸酶的结合基序SPRIEIT,CK1结合基序FSILF,更为重要的是1个被掩盖的核定位序列(nuclear localization signal,NS)。非激活状态下NFAT的Ser残基处于磷酸化状态,形成一种掩蔽NIS的构象,而这些Ser残基的去磷酸化则会导致NIS的激活。SPRIEIT基序的缺失或其中的Ser发生突变都会导致NFAT组成型核定位,而NS的缺失或突变则会导致NFAT不能发生核定位。值得一提的是,RHD区域也含有1个NS,也会受到磷酸化Ser残基的掩蔽影响,从而与NHR中的NLS共同调控NFAT的核定位。
RHD区域主要负责NFAT与DNA的结合及与AP-1( activator protein-1)等转录因子发生协同作用。通过对NFAT的RHD/DNA二元复合物的构象研究揭示,NFAT在激活靶基因表达时,是需要和AP-1家族蛋白等转录因子发生协同作用的。
NFAT蛋白C端的结构同源性较低,长度变化也较大。除了NFAT的N端以外,在其C端也存在一段非保守序列,被称之为转录激活区(tanscriptional activation domain,TAD),也能有效执行转录激活功能。
NFAT参与的信号调节机制
NFAT家族中,NFAT5是目前唯一已知的高渗透压激活的哺乳动物转录因子,NFATI-NFAT4均受细胞内钙离子信号的调控。在静息细胞的细胞质中,由于激酶(如CK1和DYRK2)的作用,NFAT处于高度磷酸化状态。当激素、神经递质等第一信使与细胞膜上的受体结合,激活膜上的G蛋白,从而激活磷酸脂酶C(phospholipase C,PLC),将膜上的脂酰肌醇 4,5-二磷酸(phosphatidylinositolbiphosphate,PIP2)分解为两个细胞内的第二信使:二酰甘油(diacylglycerol,DAG)和1,4,5-三磷酸肌醇(IP3)。IP3 动员细胞内钙库释放Ca到细胞质中,激活CN(目前已知的、唯一可以调节NFAT入核的磷酸酶),随后参与一系列的反应,比如calcineurin/NFAT 信号通路被激活;而DAG在Ca2+的协同下激活蛋白激酶C(protein kinase C,PKC),然后通过PKC引起级联反应,进行细胞的应答。
调节NFAT核转位的激酶主要分为两类,一类是输出型激酶,即负责细胞核内NFAT的磷酸化并诱导其重新定位于细胞质,主要作用于SP2和SP3,如GSK3和DYRK1等;另一类维持型激酶存在细胞质中,维持细胞质中的NFAT高度磷酸化水平并抑制静息状态下NFAT脱磷酸向细胞核转移,主要作用于SPRl和SP3,如CK1和DYRK2。NFAT的磷酸化是以一种连续磷酸化的方式进行,DYRK能够直接磷酸化NFAT1上保守的SP3基序,随后GSK3和CK1才能继续磷酸化SP2和SRR1基序;而NFAT2连续磷酸化的先导激酶是cAMP 依赖蛋白激酶(protein kinase A,PKA)和DYRK,随后是GSK3,进而导致NFAT蛋白完全磷酸化并转移出核。
近年的研究也发现了参与NFAT通路调节的新蛋白及其可能的机制:细胞质支架蛋白 Homer2和Homer3可以和NFAT竞争性结合CN,从而阻止NFAT的脱磷酸及活化;类似于泛素的蛋白质小泛素样修饰蛋白可经由类似泛素化的过程与目标蛋白质上特定的赖氨酸支链形成共价键,修饰目标蛋白质,而这个过程同样可能参与NFAT功能的调控。此外,NFAT在脊椎动物发育中有一定的作用。在神经系统中,NFAT的活化与神经元的凋亡与损伤也存在着密切的联系。
以NFAT蛋白为靶点的临床药物的开发前景
锂治疗是目前治疗神经躁郁症的主要方法。研究发现,长期注射锂的小鼠脑部GSK-3活性被抑制,神经元细胞发生NFAT3/4的核转位,从而诱导死亡配体(Fas Ligand,FasL)表达水平的上升,激活FasL/Fas凋亡通路,下游凋亡蛋白酶caspase-3表达增加,从而诱导随后的神经元凋亡。基于当前环孢菌素A(Cyclosporin A)等药物在神经系统应用的局限性,例如,在体外培养的皮层神经元中,脑源性神经营养因子BDNF可以刺激NFAT依赖的转录,而使用CsA和FK506可以阻断该过程;传入神经阻滞可以激活前腹侧的耳蜗神经元(anteroventral cochlearnucleus,AVCN)中的NFAT3,使其从细胞质移位到细胞核,诱发神经元凋亡,FK506及VIVIT可以明显抑制NFAT3的入核,减少神经元凋亡。针对NFAT以及NFAT调节信号的深入研究,将为筛选或者开发更为高效、低毒药物提供新的思路。

 联系我们
联系我们





