阿尔茨海默病(Alzheimer’s disease,AD)俗称老年痴呆症,是一种典型的神经退行性疾病,主要病理特征是脑萎缩和脑细胞死亡。该病自1906年被首次报道以来已有百年之久,目前仍未完全明确其发病机制,针对各种发病机制假说(如β淀粉样蛋白级联学说、Tau蛋白异常磷酸化学说、胆碱能学说、神经炎症等)的药物研发目前也仅有Aducanumab、Lecanemab被美国FDA批准上市。Aducanumab、Lecanemab是通过清除AD患者大脑内β淀粉样斑块而发挥作用的单克隆抗体药物。研究表明,人体内转甲状腺素蛋白(transthyretin,TTR)对AD具有神经保护作用,这种神经保护作用能够延缓AD的疾病进程。
转甲状腺素蛋白(transthyretin,TTR)负责甲状腺素和视黄醇在人体内的转运工作。正常情况下,TTR是一种同源四聚体蛋白,其四聚体结构非常稳定。但当TTR四聚体解离成单体后,TTR单体会迅速发生错误折叠并聚集形成淀粉样纤维,最终导致TTR淀粉样变性,如淀粉样心肌症。尽管TTR的错误折叠与TTR淀粉样变性密切相关,但多项证据表明,TTR对AD具有神经保护作用。那么,TTR与Aβ二者作用的详细机制如何?是否可为TTR神经保护作用机制的抗AD药物设计提供理论依据?
The initial structures for protein-protein docking
针对转甲状腺素蛋白(transthyretin,TTR)和Aβ蛋白的研究,首先需要高质量的蛋白满足研究需求。作为法国ProteoGenix、Antibodysystem品牌亚洲区独家运营代理商。提供近2万种以蛋白、抗体为核心的生命科学试剂,旨在为生命科学科研工作者提供专业、全面、可靠的试剂产品。这项研究中,我们不但可提供研究所需的针对转甲状腺素蛋白(transthyretin,TTR)和Aβ蛋白,还可提供更多AD疾病相关的蛋白抗体试剂。

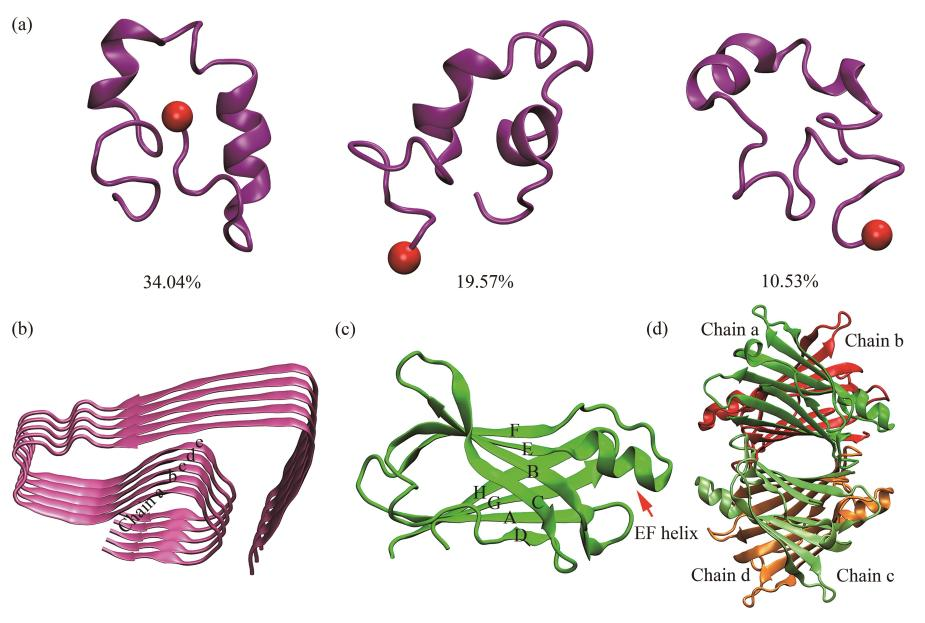
常见的Aβ形式有Aβ1-40及Aβ1-42,但Aβ1-42在体内的聚集倾向及细胞毒性更强,通常使用Aβ1-42来作为研究对象。该结构是一个通过冷冻电镜技术辅以固体NMR实验获得的近原子分辨率的纤维聚集体结构,结构中所有42个残基的骨架和几乎所有的侧链在冷冻电镜密度图中都得到很好的解析。研究表明,较小的可溶性Aβ低聚体是Aβ细胞毒性的主要形式,因此在研究转甲状腺素蛋白(transthyretin,TTR)与Aβ蛋白机制时,以五聚体作为Aβ低聚体的代表形态更具代表性。
为了获得用于描述TTR/Aβ相互作用的复合物结构,进行蛋白质-蛋白质的分子对接。为探究TTR及Aβ不同结构形态对二者相互作用的影响,分别对TTR单体/Aβ单体、TTR四聚体/Aβ单体、TTR单体/Aβ五聚体及TTR四聚体/Aβ五聚体进行了分子对接,各体系分别标记为AβTTRM、AβTTRT、AβOTTRM和AβOTTRT。为了深入探究TTR与Aβ的相互作用过程,进一步对各体系进行了分子动力学模拟。
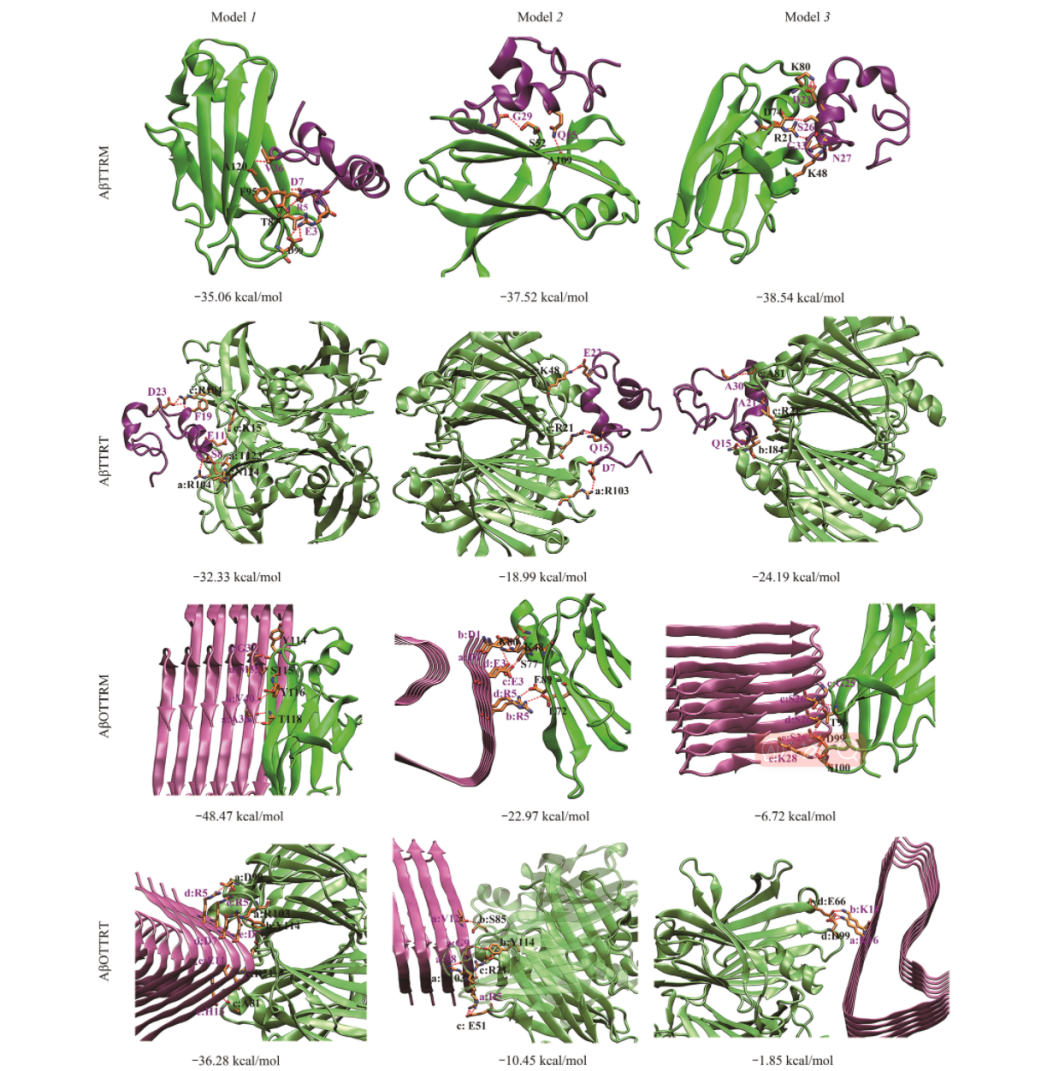
The protein-protein docking models for each system
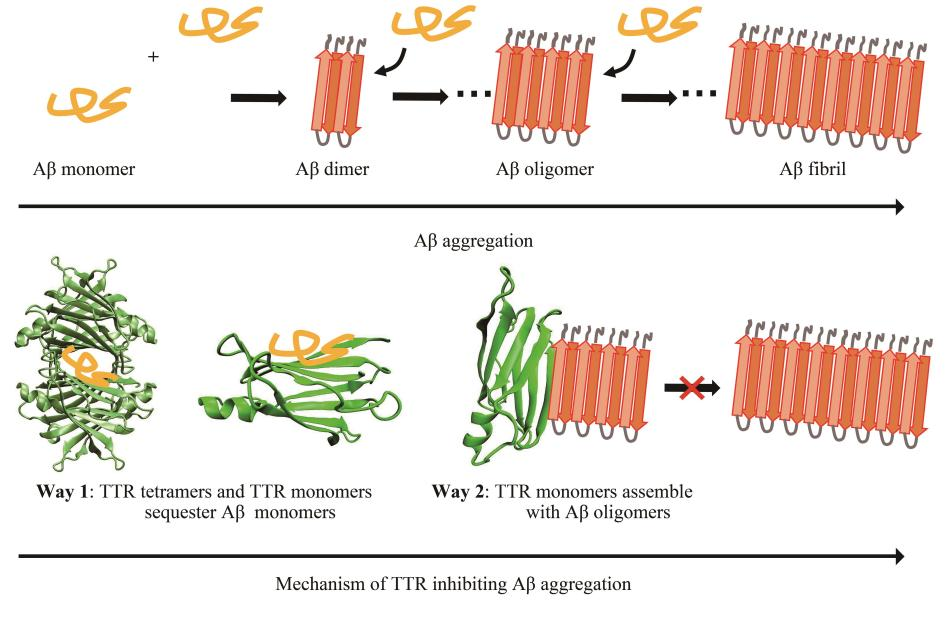
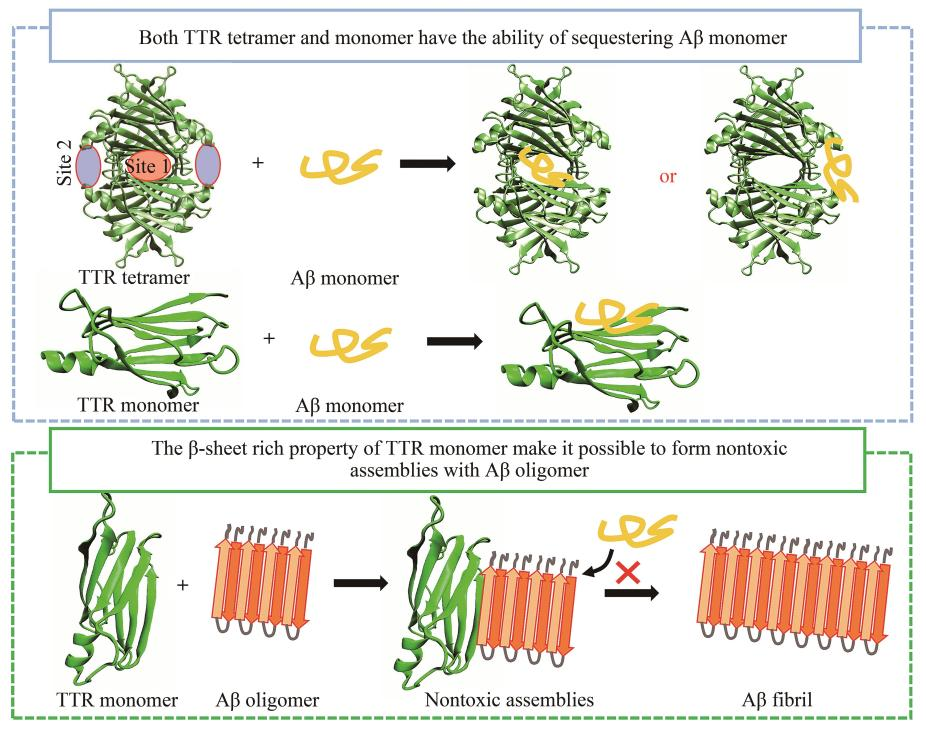
结果表明,TTR四聚体及单体均能与Aβ单体作用,TTR四聚体的甲状腺素结合通道是Aβ单体的主要结合部位。此外,TTR四聚体的EF螺旋、EF loop同样能够结合Aβ单体。当TTR四聚体解离后,TTR单体的内部片层疏水部位暴露,该部位对Aβ单体具有较强的亲和力。TTR与Aβ聚集体作用,由于TTR单体与Aβ聚集体均为富含β折叠的结构,使得二者能够共聚集形成聚合度更高的聚集体,从而降低Aβ聚集体的细胞毒性。
The illustration of speculative interaction mechanisms between TTR and Aβ
这项研究表明,TTR结构的特殊性使得其对Aβ单体具有较强的相互作用能力,可通过“扣押”单体的形式抑制Aβ的聚集。这种结构特殊性表现为:a. 正常情况下TTR以稳定四聚体形式存在,其结构中的T4结合通道及视黄醇结合部位为Aβ提供了适当的结合空间,有利于Aβ单体的结合;b. 四聚体解离产生TTR单体,导致疏水界面DAGH折叠片层的暴露,使得Aβ单体同样能够作用于该疏水界面(Aβ单体的疏水核心为17LVFFA21),达到“扣押”Aβ单体的作用。其次,TTR单体的结构特征与Aβ聚集体的结构相似,均为富含β折叠的结构,这使得TTR单体能够与Aβ聚集体共聚形成聚合度更高的无毒聚集体,从而达到抑制Aβ细胞毒性的效果。整体而言,本工作在原子尺度上探究了TTR与Aβ相互作用的机制,并揭示了TTR神经保护作用的分子机制,在一定程度上为基于TTR神经保护作用机制的抗AD药物研发提供了理论线索。
参考文献
- ZHOU Shuang-Yan,HUANG Yao-Xin,LI Xin,et al.Molecular Mechanism Study of β-amyloid Aggregation Inhibition by Transthyretin[J].Progress in Biochemistry and Biophysics,2024,51(03):633-646.
- Xu H, Zhao Y, Qi Y, et al. Therapeutic nanosweepers promote β‑amyloid removal from the brain for Alzheimer’s disease treatment. Biomater Sci, 2022, 10(22): 6525-6534
- Guo X, Lie Q, Liu Y, et al. Multifunctional selenium quantum dots for the treatment of Alzheimer’s disease by reducing Aβ‑neurotoxicity and oxidative stress and alleviate neuroinflammation. ACS Appl Mater Interfaces, 2021, 13(26): 30261-30273
- Ueda M, Transthyretin: its function and amyloid formation. Neurochem Int, 2022, 155: 105313
- Cao Q, Anderson D H, Liang W Y, et al. The inhibition of cellular toxicity of amyloid‑β by dissociated transthyretin. J Biol Chem, 2020, 295(41): 14015-14024
- Cotrina E Y, Santos L M, Rivas J, et al. Targeting transthyretin in Alzheimer’s disease: drug discovery of small-molecule chaperones as disease-modifying drug candidates for Alzheimer’s disease. Eur J Med Chem, 2021, 226: 113847

 联系我们
联系我们





