抗体偶联药物(antibody drug conjugate,ADC)通常由抗体通过链接体与毒素小分子偶联而成,因其同时具备抗体的高靶向性和小分子药物的高活性,在肿瘤治疗领域展现出了优秀的疗效和潜力,成为药物研发领域的新热点。目前全球已有14款ADC药物获批上市,处于临床研究阶段的ADC候选药物分子超过140个。
抗体偶联药物(antibody drug conjugate,ADC)作为一类新兴的大分子靶向药物,目前主要用于各种肿瘤。ADC药物由靶向肿瘤细胞过度表达的表面受体的抗体、高活性的细胞毒素小分子和链接体3个部分组成。其中,抗体部分负责将ADC药物分子精准运送至靶细胞表面,链接体负责在靶细胞内或表面释放毒素小分子,而高活性的细胞毒素小分子则高效地杀伤肿瘤细胞,因此ADC也被通俗地称为“生物导弹”或者“魔法子弹”。
魔法子弹这一概念是由诺贝尔奖获得者德国科学家Paul Ehrlich在20世纪初提出的,特指一类能靶向结合目标病灶进而治愈疾病的一类分子。1957年,Mathé等将化疗药物甲氨蝶呤通过重氮偶合反应偶联至抗L1210白血病细胞的免疫球蛋白上实现对靶细胞L1210抑制细胞增殖,从而将这一概念实物化为抗体加上毒素小分子这一药物分子形式。1970年代中期,有多个利用动物源免疫球蛋白制备的ADC在临床试验中展现出了确定的疗效。1980年代,单克隆抗体开发技术和重组蛋白生产技术的进步、多种肿瘤标志物的确证以及对靶点抗原-抗体介导的细胞内吞机制的阐明,同时在靶点、抗体以及链接体等多个方面给ADC药物的技术发展带来了巨大推动力,进而在1990年代吸引了药物研发和生物科技公司加大投入ADC药物的开发,并于2000年迎来第一个ADC药物Mylotarg®的获批上市。Mylotarg®是CD33靶向的ADC用于治疗急性髓系白血病(acute myeloid leukemia,AML)。随后,用于治疗霍奇金淋巴瘤(Hodgkin lymphoma,HL)和间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)的CD30靶向的Adcetris®在2011年获批上市,用于治疗晚期转移性乳腺癌的HER2靶向的Kadcyla®于2013年获批上市。这两款ADC药物在晚期肿瘤患者中的显著疗效和良好的安全性,使得ADC药物正式作为一类新型的治疗手段得到肿瘤患者、肿瘤医疗界和生物制药工业界的广泛认可,迅速成为了全球生物医药学术界以及工业界的热点领域之一。截至2023年3月全球已有14款ADC药物获批上市,其中9款是在近5年内获批的,处于临床研究阶段的ADC药物分子则超过140个,而且呈现逐年快速增长的趋势,有望给肿瘤患者带来更有效的治疗药物。
|
商品名 |
药品通用名 |
靶标 |
适应症 |
抗体 |
链接体 |
毒素 |
开发者 |
批准时间 |
|
Mylotarg® |
Gemtuzumab ozogamicin |
CD33 |
AML |
人源化IgG4 |
腙 |
卡利霉素 |
辉瑞(惠氏) |
2000年FDA
|
|
Adcetris® |
Brentuximab vedotin |
CD30 |
HL、sALCL |
人鼠嵌合IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
西雅图遗传 |
2011年 FDA;2020年NMPA |
|
Kadcyla® |
Trastuzumab ado-emtansine |
HER2 |
mBC |
人源化IgG1 |
硫醚 |
DM1 |
罗氏/基因泰克 |
2013年 FDA;2020年NMPA |
|
Besponsa® |
Inotuzumab ozogamicin |
CD22 |
ALL |
人源化IgG4 |
腙 |
卡利霉素 |
辉瑞 |
2017 年EMA&FDA;2021年NMPA |
|
Lumoxiti® |
Moxetumomab pasudotox |
CD22 |
R/R HCL |
鼠源免疫球蛋白可变区 |
融合蛋白 |
假单胞菌外毒素A |
阿斯利康 |
2018 年FDA |
|
Polivy® |
Polatuzumab vedotin |
CD79b |
DLBCL |
人源化IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
罗氏/基因泰克 |
2019年 FDA
|
|
Padcev® |
Enfortumab vedotin |
Nectin-4 |
mUC |
人源化IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
安斯泰来/西雅图遗传 |
2019年 FDA
|
|
Enhertu® |
Trastuzumab deruxtecan |
HER2 |
mBC |
人源化IgG1 |
四肽 |
Dxd |
第一三共/阿斯利康 |
2019年 FDA 2023年NMPA |
|
Trodelvy® |
Sacituzumab govitecan |
Trop-2 |
mTNBC |
人源化IgG1 |
碳酸酯 |
SN-38 |
Immunomedics |
2020年 FDA 2022年NMPA |
|
Blenrep® |
Belantamab mafodotin |
BCMA |
R/R MM |
人源化IgG1 |
马来酰亚氨基己酰 |
MMAF |
葛兰素史克 |
2020年 FDA
|
|
Zynlonta® |
loncastuximab tesirine |
CD19 |
R/R LBCL |
人源化IgG1 |
缬氨酸-丙氨酸 |
PBD二聚体 |
ADC Therapeutics |
2021年 FDA
|
|
爱地希® |
Disitamab vedotin |
HER2 |
mGC |
人源化IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
荣昌生物 |
2021年NMPA |
|
Tivdak® |
Tisotumab vedotin |
TF |
mCC |
人源化IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
西雅图遗传/Genmab |
2021年 FDA
|
|
ElahereTM |
Mirvetuximab soravtansine |
FRα |
铂治疗失败OC |
人源化IgG1 |
sulfo-SPDB |
DM4 |
ImmunoGen |
2022年 FDA
|
AML:间变性髓系白血病(anaplastic myeloid leukemia);HL:霍奇金淋巴瘤(Hodgkin lymphoma);sALCL:系统性间变性大细胞淋巴瘤(systemic anaplastic large cell lymphoma);mBC:转移性乳腺癌(metastatic breast cancer);ALL:急性淋巴细胞白血病(acute lymphocytic leukemia);R/R HCL:复发/难治性毛细胞白血病(relapsed/ refractory hairy cell leukemia);DLBCL:弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma);mUC:转移性尿路上皮癌(metastatic urothelial cancer);mTNBC:转移性三阴性乳腺癌(metastatic triple negative breast cancer);R/R MM:复发/难治性多发性骨髓瘤 (relapsed/refractory multiple myeloma);R/R LBCL:复发/难治性大B细胞淋巴瘤(relapsed/refractory large B cell lymphoma);mGC:转移性胃癌(metastatic gastric cancer);mCC:转移性宫颈癌(metastatic cervical cancer);OC:卵巢癌(ovarian cancer);PBD:pyrrolobenzodiazepine
这些ADC药物的成功获批上市,一方面证明了此类新型药物对于肿瘤治疗的显著疗效和潜力,另一方面这些药物在临床试验和获批上市后大量病人使用过程中也逐步揭示了现有ADC药物的局限性,例如脱靶毒性、复杂的药代动力学特性、靶标组织富集度不足、耐药性、实体瘤穿透力不够等。为了进一步提高ADC药物的疗效,降低其毒副作用,各种新颖的技术和解决方案层出不穷。
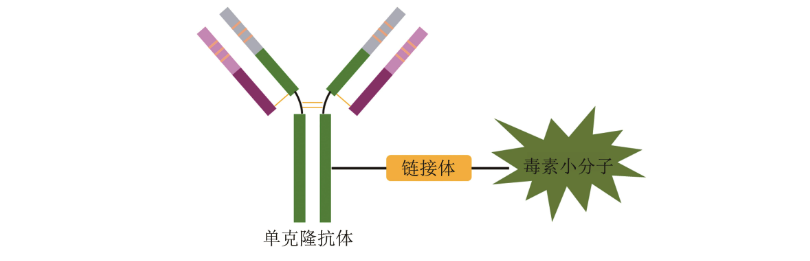
经典的ADC药物由单克隆抗体、链接体和毒素小分子3部分组成。每个组成部分发挥着不同的功能:抗体部分负责将ADC分子选择性地递送至肿瘤细胞表面,同时通过靶点介导的内吞作用进入到细胞内;链接体则负责在肿瘤细胞内或者表面高效释放毒素小分子,而在血液循环系统中保持稳定;毒素小分子则负责高效地杀伤肿瘤细胞,有些小分子还同时具备细胞穿膜渗透性,可以通过扩散效应作用于靶细胞周围的肿瘤细胞,起到“旁杀效应(bystander effect)”。因此,ADC药物每个组成部分的特性都对其发挥靶向治疗作用至关重要,同时各个组分的选择也都可能会影响到ADC的安全性和有效性。
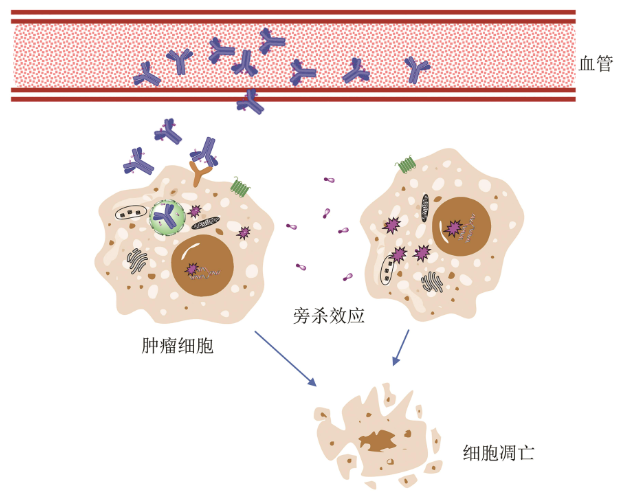
ADC杀伤肿瘤细胞的作用机制
作为ADC药物的主体框架结构和导航系统,理想的抗体组分需具备较低的免疫原性、特异性的靶点结合和高亲和力、较长的半衰期、良好的血液循环系统稳定性以及能介导高效的内吞效应等特性。抗体是ADC分子的主要组成部分,占其分子质量的80%以上,ADC的潜在免疫原性主要来源于抗体。
早期的ADC药物,由于采用鼠源的抗体,通常会在病人体内引发较强的免疫反应,产生抗药抗体,进而导致疗效降低和其他副反应。为了克服免疫原性这一缺点,人鼠嵌合抗体和人源化抗体应运而生。人鼠嵌合抗体是由鼠源的抗原结合区(Fab)与人源的恒定区(Fc)嵌合而成,此种组合大大降低了其免疫原性,采用嵌合抗体的ADC也在临床上展现了良好的疗效和耐受性。普健生物深耕蛋白抗体领域15余年,在嵌合抗体制备技术上拥有自主核心技术,与知名科研单位、研究院所、医药研发企业成功合作相关项目20000+,拥有丰富的多物种(人、小鼠、大鼠、兔、羊驼)嵌合抗体生产经验,能提供从抗原制备,到抗体生产,标记,检测,测序等全流程技术支持。如果您想咨询相关技术或有相关嵌合抗体生产需求,欢迎联系027-87001869进行交流咨询。
人源化抗体仅保留鼠源的抗原抗体结合域(complementarity determining region,CDR),Fc片段及其他框架结构则采用人源的,这样也进一步降低了抗体的免疫原性。当然,除了利用单克隆抗体作为载具的ADC外,也有很多研究尝试使用其他形式的抗体,例如双抗、抗体片段或纳米抗体等来开发ADC,以进一步提高ADC药物的安全性和有效性。
ADC药物目前面临的挑战之一是分子质量过大,难于穿越各种生物屏障到达并穿透实体瘤肿瘤组织,影响其治疗实体瘤的效果。为了提高ADC药物治疗实体瘤的效果,研究者们希望通过缩小抗体框架结构来降低ADC的总体分子大小,增强其肿瘤穿透力,质量小、稳定性高、亲和力强的纳米抗体成为研究者们的不二之选。
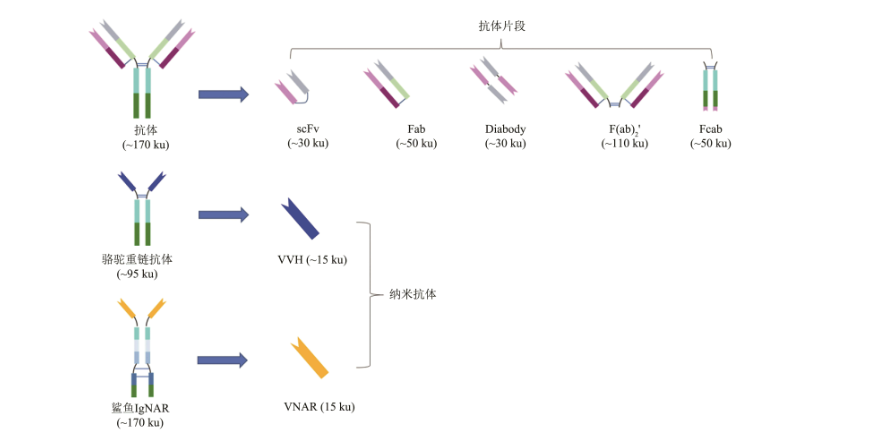
在天然抗体片段中,利用Fab来设计ADC分子的研究较多。Fab片段包括抗体的单侧抗原结合臂,由抗体的轻链和重链可变区加CH1区段组成,分子质量约为50 ku,可通过酶解完整抗体或者重组表达获得。以scFv及其衍生体作为载体则是缩小版ADC的另一个研究方向,scFv由抗体的轻链和重链的可变区通过一段短肽或者二硫键链接而成,其分子质量约为30 ku,且容易在原核细胞中表达,scFv类的ADC已在多个临床前研究中显示出良好的可开发潜力。
链接体负责将ADC的抗体和细胞毒小分子链接在一起,对于ADC药物的安全性和稳定性至关重要。链接体一般包括4个分子片段:抗体连接片段、调节片段、酶降解片段和自裂解片段。开发者通常依据毒素小分子的特性以及与抗体连接的方式,并结合对ADC分子的影响,开展综合分析评估来筛选上述4个片段,最终确定链接体的结构。
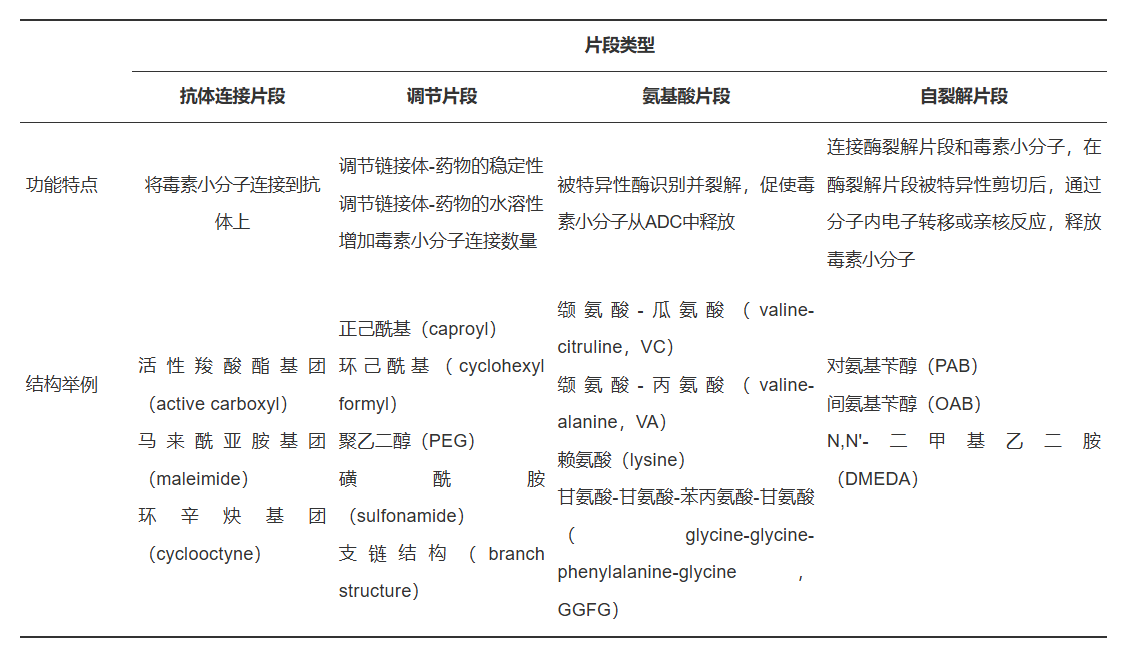
链接体的稳定性决定了ADC药物中的毒素小分子是传递到肿瘤细胞内部还是有可能在运输过程中过早释放并跟随血浆传递到所有组织,显著影响ADC药物的安全性和有效性。ADC药物的稳定性一般受抗体与链接体的偶联方式、调节片段和氨基酸片段3个方面的影响,其中,偶联方式由抗体连接片段决定。

毒素小分子是ADC药物中主要负责执行细胞杀伤功能的组件,它需要具备较高的活性使之能在较低的剂量下有效杀伤肿瘤细胞。目前主流的ADC药物其毒素小分子的细胞抑制的IC50基本在10-9~10-12 mol/L范围之间。同时,它还需要具备很好的稳定性,使之在循环系统和溶酶体中保持结构完整和活性。另外,它还需要分子质量足够小,免疫原性低,也需具备方便与链接体进行化学反应的位点。

ADC药物开发成功的另一个重要元素是将小分子组分(链接体或链接体-毒素小分子)加载在抗体分子上的方式和技术。偶联反应策略和过程,决定了载药量(drug antibody ratio,DAR)和载药分布方式等关键质量属性,与ADC药物的有效性和安全性直接相关。
目前的ADC偶联技术大致可以分为两种类别,一种是利用抗体序列中天然的具备反应活性的氨基酸残基(如表面赖氨酸的侧链氨基和链间二硫键还原后的巯基)来介导的偶联技术;另一类技术,则是通过化学修饰、基因工程技术或者酶修饰等手段在抗体特定位点引入可供反应的基团,再偶联上毒素小分子,实现特定位点偶联。
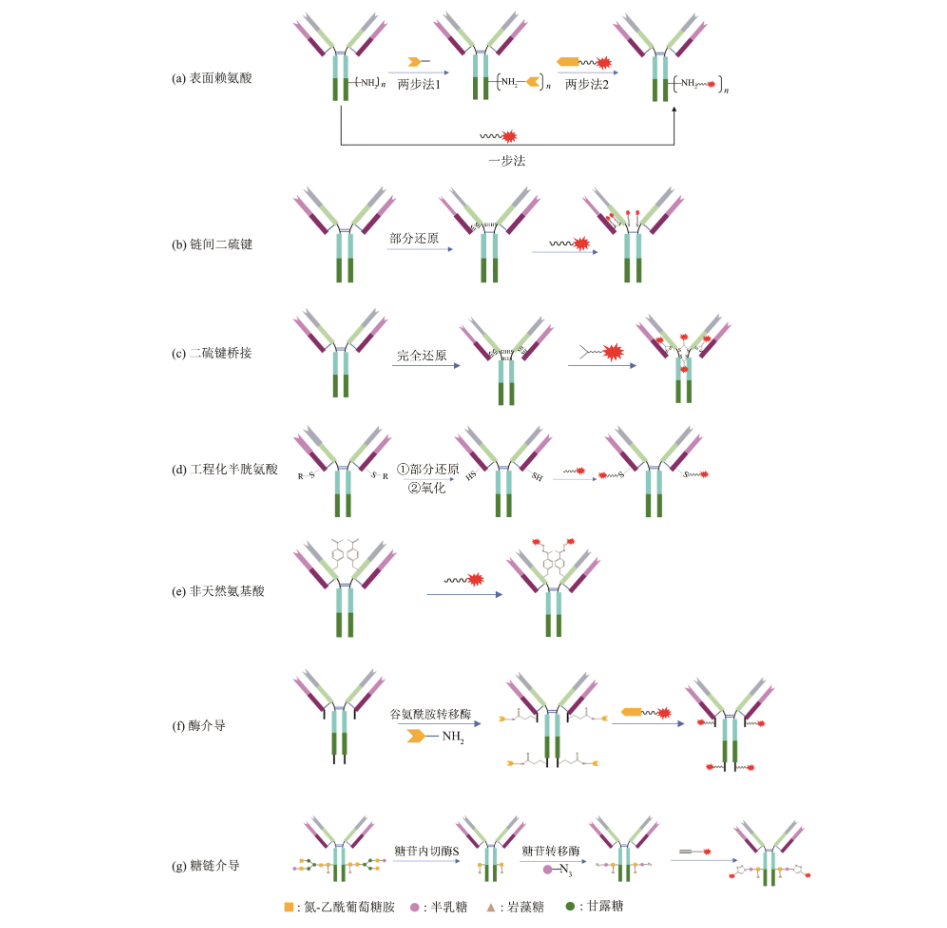
ADC药物设计的本质是利用抗体的高选择性靶向运输能力将具有生物学效应的小分子药物高效地递送至病灶发挥治疗作用,既是一种新型药物分子,又是一种靶向递送系统。在这一体系内,抗体、链接体、小分子以及偶联技术等关键要素都需要都需要考虑,针对靶点的生物学特征以及疾病的特性和机理,选择高特异性抗体、偶联技术对于开发成功的ADC药物更是至关重要。普健生物作为您身边的一站式蛋白抗体开发专家,随时为您提供创新的抗体蛋白制备技术,并基于自身的自主产权知识帮助ADC研究人员提供高质量抗体,助力ADC药物研究。相信在ADC领域研究者的共同努力下,克服现有ADC的缺点和挑战,下一代的ADC药物将会给肿瘤的靶向治疗带来新惊喜,使更多的肿瘤患者获益。另外,作为一种递送系统,相信将来ADC药物必将用于更加广泛的领域,如中枢神经疾病、遗传疾病和感染性疾病等领域,作为真正高效的“魔法子弹”去消灭疾病,拯救生命。

 联系我们
联系我们





