近期,《美国国家科学院院刊》发表一项研究发现了一种蛋白质可以促进小鼠心脏移植耐受性,这一发现可能为人类移植排斥反应的更精确免疫疗法铺平道路。

心脏移植是严重心力衰竭患者最后的尝试,接受同种异体心脏移植的患者也需要在余生中服用免疫抑制剂。在美国,根据器官共享联合网络的公开数据,每年有超过3800例心脏移植临床,这个数字在过去十年中稳步上升。大约30%的心脏移植受者将在手术后的第一年内经历排斥反应。研究人员对移植耐受力的研究主要是基于免疫系统对外来移植物具有耐受性,但仍能对传染源或其他类型的病原体做出反应。在这项研究中,研究团队对小鼠心脏移植排斥和耐受组织进行了单细胞RNA测序。他们发现,HIF-2a蛋白存在于耐受移植的小鼠的巨噬细胞(一种白细胞)中,但不存在于经历排斥反应的小鼠中。
HIF-2a或缺氧诱导因子2 α在器官移植过程中发生的细胞缺氧反应中起着关键作用。研究人员对实验性免疫耐受的细胞、分子和转录特征进行了深入研究,结果令人惊讶,因为研究人员发现最大的特征之一是在移植领域通常没有深入研究的细胞群中:巨噬细胞。
通过进一步的流式细胞术分析和抑制移植组织中的HIF-2a,研究人员发现HIF-2a对移植耐受性至关重要。这些发现强调了HIF-2a的未被重视的作用,以前认为它只会增加炎症。
最后,研究人员能够选择性地靶向这种转录因子HIF-2a,并重新编程先天免疫细胞,以增强对实验性移植的耐受性;在移植小鼠中给予旨在提高HIF-2a的药物,并发现这导致了移植耐受性的增加。
知识拓展:关于HIF-2α
HIF-2α是HIFs家族蛋白之一,人类HIFs家族蛋白有3个:HIF-1、HIF-2和HIF-3。其中,HIF-2α与HIF-1α结构密切相关,共有约48%的相同氨基酸组成,是细胞适应缺氧的主要调控因子。低氧诱导因子(hypoxia-inducible factor, HIFs)是进化上高度保守的异二聚体转录因子的基本螺旋-环-螺旋家族Per-Arnt-Sim (basic helix-loop-helix/Per-Arnt-Sim, bHLH-PAS)的成员,可调节数千个基因的反应。这些异二聚体由缺氧诱导与氧敏感的α亚基(HIF-α)和组成型表达的β亚基(HIF-β)组成,后者也称为芳基烃受体核转运体(aryl hydrocarbon receptor nuclear translocator, ARNT)。在常氧条件下,HIF-α受到HIF脯氨酸羟化酶(prolyl‐hydroxylases, PHDs)的严格调控,该酶可在特定的脯氨酸残基上迅速羟基化HIF亚基,随后被Vhl抑癌基因(von hippel-lindau, VHL)E3连接酶识别并最终通过蛋白酶体途径降解。此外,抑制HIF-α的因子(factor inhibiting HIF,FIH)也可羟基化HIF-α亚基,导致其转录活性降低。在缺氧条件下,因PHD和FIH活性降低,HIF-α稳定易位至细胞核中,HIF-α/β复合物与含有缺氧反应元件(hypoxia response elements, HREs)的靶基因启动子结合,并反式激活多种信号通路基因的表达,包括肿瘤转移、细胞存活、血管生成、代谢、炎症和免疫功能等等。
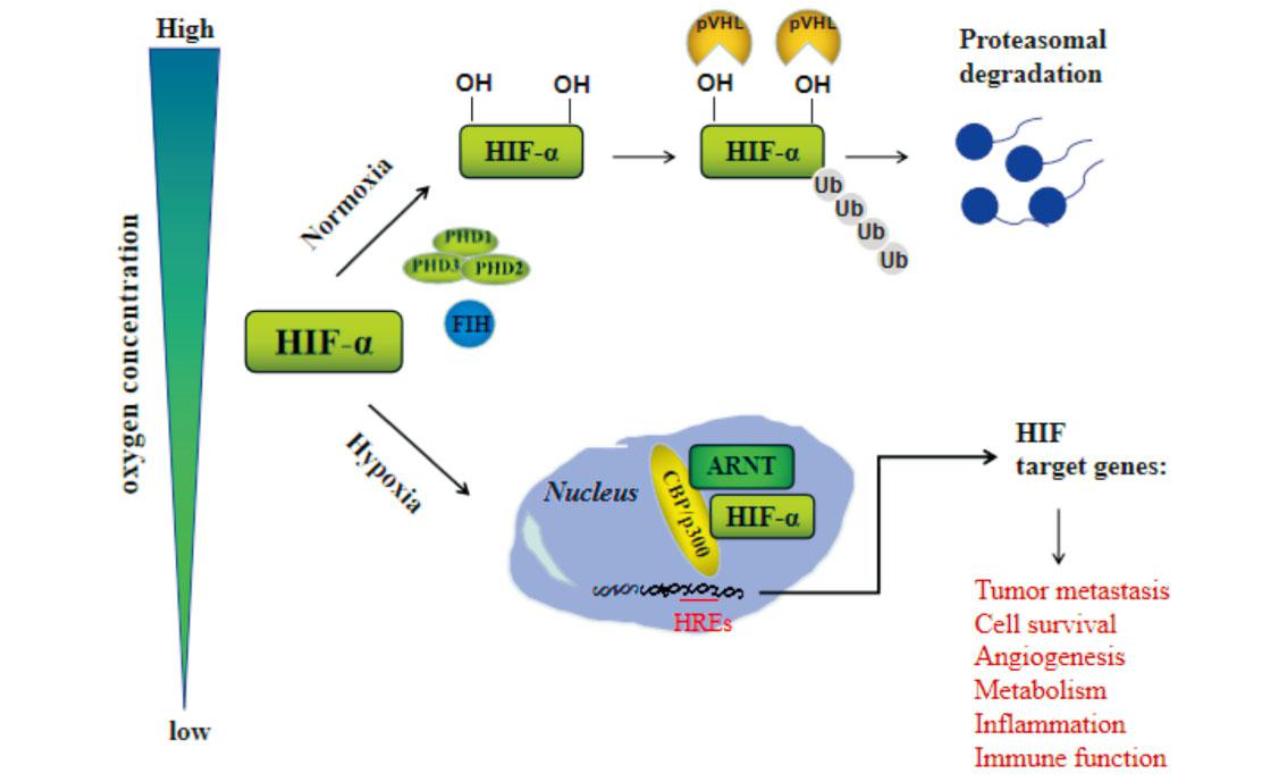
HIFs信号调节示意图
这项研究的创新之处在于揭示了HIF-2α在调节移植耐受性中的新作用,特别是通过调控CSF1R的表达来促进耐受性巨噬细胞的形成。这一发现不仅增进了我们对移植免疫耐受机制的理解,而且为开发新的治疗策略提供了可能。通过激活巨噬细胞中的HIF-2α,未来可能实现减少免疫抑制药物的使用,从而降低移植后的并发症风险,提高移植患者的长期生存率。
总之,这项研究为心脏移植领域带来了新的希望,为未来的临床治疗提供了新的方向和策略。

 联系我们
联系我们





