抗原特异性B细胞群体是发现治疗性单克隆抗体(mAb)的关键资源,源自自然感染的人类或人工免疫后的动物(包括小鼠、大鼠、鸡、兔和羊驼),这些细胞大多从供体血液样本或免疫后的小鼠脾脏中分离。今天,小编将带领大家一起深入探究这些常规单克隆抗体生产技术,了解它们是如何从实验室走向世界的每一个角落,成为守护健康的强大武器。
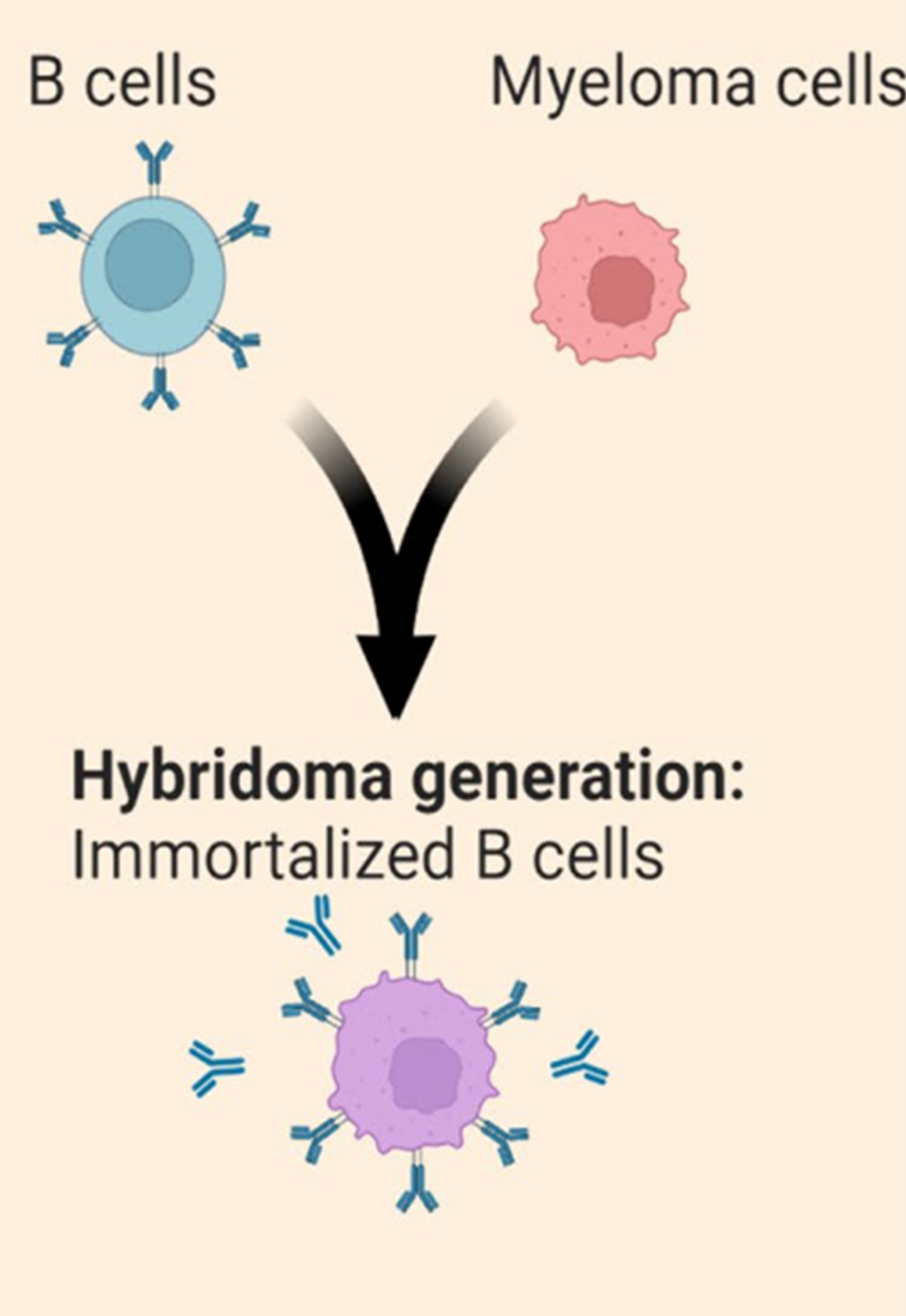
杂交瘤技术
由1984年诺贝尔奖得主Cesar Milstein和Georges Kohler于1975年创立,成为了1986年美国食品和药品监督管理局(FDA)核准的第一个抗体Muromonab-CD3(商品名OKT3)的孵化摇篮。此技术的核心在于运用电融合法或化学介导的融合,使原初B细胞与骨髓瘤细胞(一种B细胞恶性肿瘤细胞系)结合,实现B细胞的永生化。杂交瘤技术的一个潜在缺点是细胞融合过程的效率有限。融合后,单个B细胞克隆通常通过有限的稀释进行划分。连续分泌IgG的克隆细胞允许对未纯化的细胞上清进行中等通量筛选,以鉴定具有所需结合活性的克隆,例如,利用酶联免疫吸附测定(ELISA)进行亲和性验证。杂交瘤技术之所以吸引人是因为它保留下了原本的VH/VL配对,且在治疗性抗体应用方面取得了成功。现有多款出自杂交瘤的单克隆抗体获得了FDA的认可,成为市场上的治疗药物。该技术主要用于小鼠、大鼠和兔子的B细胞永生化。为了鉴定全人抗体候选物,XenoMouse、HuMab-mouse和Alloy-GKmouse等转基因小鼠模型也为传统杂交瘤技术提供了有价值的B细胞来源,并分离出了经FDA批准的单克隆抗体。总体而言,杂交瘤技术仍然是挖掘治疗性IgG的常见和可靠途径。
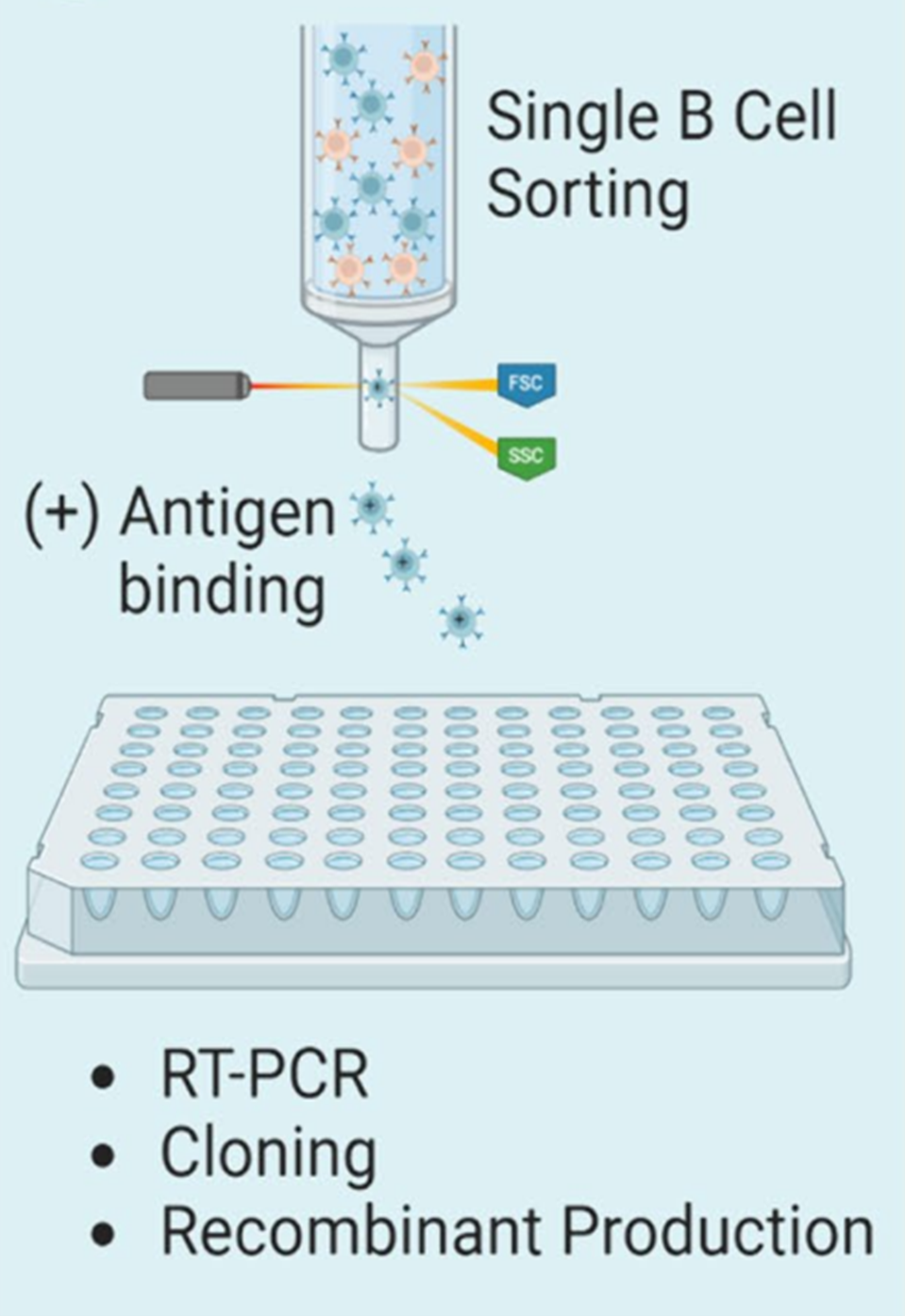
单B细胞筛选
单B细胞筛选作为杂交瘤技术的有力替代,标准化的筛选流程包括:B细胞首先通过磁珠分选(MACS)进行富集,根据细胞标记物标记抗原和抗体进行正性和负性选择,确保仅选取那些表达了目标抗原或抗体的细胞。随后,采用荧光激活细胞分选(FACS)技术,精确无误地每孔一个细胞,为了提取并解析完整的VH/VL基因对,将细胞内的RNA通过逆转录聚合酶链反应(RT-PCR)转换成cDNA形式,再通过PCR针对性扩增VH与VL编码区,生成足够数量的基因模板,进行Sanger测序,优选出的IgG随即被克隆,表达,纯化,最终筛选所需的生物学以及生物物理性质。创新微流控技术更是让单细胞水平的RT-PCR成为可能,一个流式细胞仪分选的抗原特异性B细胞池被划分为每个微滴中的一个细胞,从而可以在微滴中进行小型化的RT-PCR,继而通过二代测序和BCR分析筛检候选抗体IgG。对比杂交瘤,单B细胞筛选省去了细胞融合环节,避免了每十万细胞中只有一个存活分泌抗体B细胞的局限。
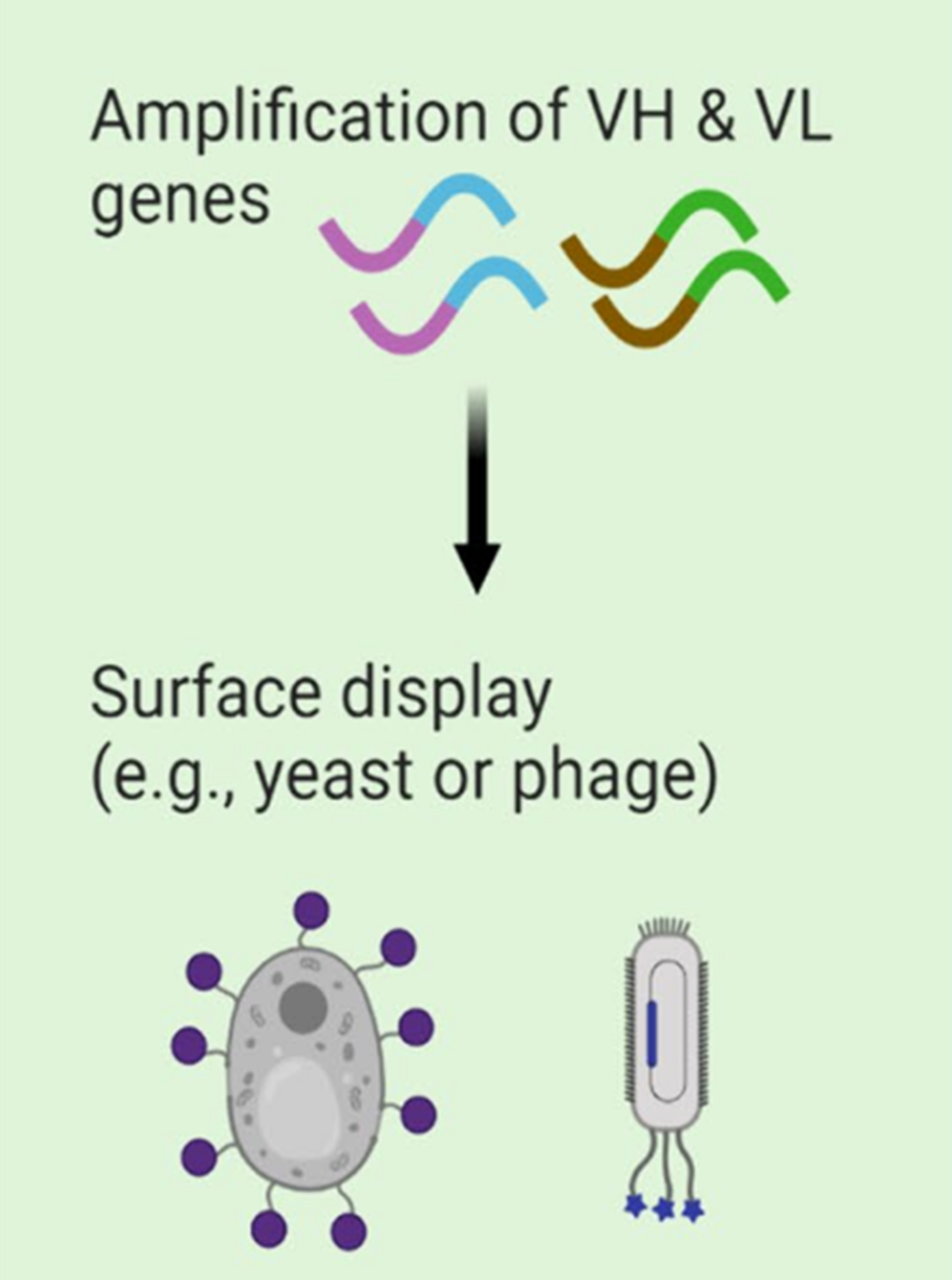
表面展示技术
除传统的杂交瘤技术和单B细胞筛选外,体外表面展示技术,特别是噬菌体和酵母展示,成为高通量筛选抗体片段的有力工具。
噬菌体展示:最早也是最广泛应用的形式之一,利用噬菌体作为展示载体,将肽段或蛋白质插入噬菌体外壳蛋白的基因中,使目的肽与噬菌体颗粒的表面展示出来。这一方法可用于筛选抗体、激酶抑制剂等。
酵母展示:使用酿酒酵母或其他真核微生物作为宿主,展示出来的蛋白质更接近天然构象,适合筛选具有复杂折叠和糖基化修饰的蛋白质,如抗体。
细菌展示:通过改造细菌如大肠杆菌的膜蛋白,使目的蛋白在细胞表面表达,适用于高通量筛选和蛋白质工程。
体外表面展示技术不仅适用于抗原经验丰富的抗体库,还适用于原始抗体库的筛选。后者的一个显著优点在于避免了构建完整免疫应答所需耗时(数周乃至数月),这一点在应对传染病时尤为重要。相比而言,从原始基因库(>10^10变异体)中筛选,更能迅速获取高亲和力抗体。筛选大规模、多样化的原始库,分离出的克隆亲和力通常与文库规模呈正相关,显示出在传染病治疗性抗体发现中的实用性,如针对SARS-CoV-2的情况所示。
相较于杂交瘤技术和单细胞筛选,表面展示技术因其易于进行多次循环筛选的特点,能有效精选出高亲和力、高选择性的克隆。多项FDA批准的单克隆抗体,如著名药物Humira(阿达木单抗),正是得益于此类技术而得以发现。
从杂交瘤到单细胞技术,再到表面展示,每一阶段都为抗体发现开辟新径,促进免疫学研究与治疗性抗体开发。

 联系我们
联系我们





