蛋白质是生物体的基本组成成分,是生命功能的执行者。深入研究某种蛋白的功能及作用机制,对蛋白在医药、工业、科研等方面的应用具有重要价值。而要研究某一个特殊的蛋白,就要先将这个蛋白从生物体中分离纯化出来。蛋白纯化在蛋白工程中是必不可少的一步,从研究蛋白的结构与功能,到对蛋白进行修饰改造,以及最后批量开发相关产品,首先都需要获得单一的蛋白。
蛋白分离纯化是用生物工程下游技术从混合物之当中分离纯化出所需要得目的蛋白的方法,在蛋白质研究中起到桥梁作用,成为当代生物技术行业的核心。蛋白纯化工作复杂,耗时长,但又十分重要。
蛋白纯化总原则:
以合理的效率、速度、收率和纯度,将目标蛋白分离出来,同时保留其生物学活性和化学结构完整性。
纯化依据——蛋白不同的理化性质(如分子大小、分子形状、带电特性、溶解特性、吸附性质、与配体的特异性结合、变性和复性等)。
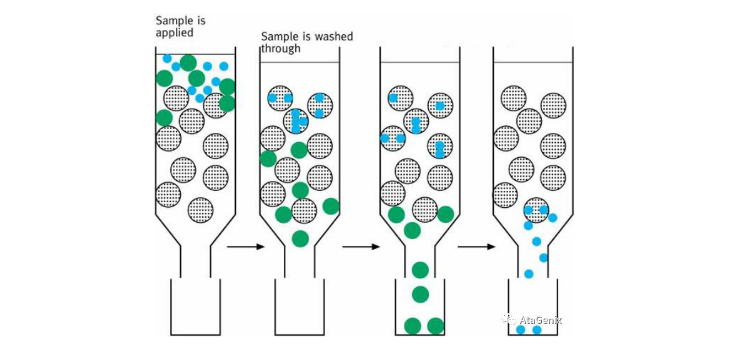
常用的蛋白质分离纯化技术有膜分离技术、沉淀分离技术、电泳分离技术以及层析分离技术等。目前层析技术是蛋白纯化领域的核心技术,也是应用最多最为广泛的技术。
层析分离技术是根据被分离物与层析固定相之间的物理化学性质以及生物学性质的相互作用来进行分离。层析法的种类繁多,应用较为广泛的有凝胶过滤层析、离子交换层析、疏水层析以及亲和层析。
不同的蛋白特性对应不同的纯化方法:
分子大小——凝胶过滤层析
带电性——离子交换层析
疏水性——疏水层析
配体特异性——亲和层析
在蛋白纯化过程中,经常通过添加合适的标签辅助蛋白纯化,促进蛋白可溶性。
常用的几种蛋白纯化标签比较:
6His,蛋白纯化首选标签,分子量小,对蛋白无影响,能纯化可溶性/包涵体蛋白。
GST,增强蛋白可溶性,仅能纯化可溶性蛋白,屏蔽毒性蛋白,标签较大。
MBP,增强蛋白可溶性,屏蔽毒性蛋白,标签较大,对蛋白结构/功能会有一定影响。
Myc,高特异性,在天然洗脱条件下,使用Myc标签多肽来与重组蛋白进行竞争,可温和洗脱Myc标签蛋白质。
SUMO,增强蛋白可溶性,切割特异性极高,不残留任何氨基酸,适合重组蛋白表达。
Strep,不会影响标签蛋白的功能结构,更简便,适合高纯度蛋白产出。
Flag,通常不与目的蛋白相互作用,纯化效率高,应用广泛。
当然,有时我们需要根据下游实验的需求将添加的蛋白标签去除,这时就要靠工具酶了☟
标签切除蛋白酶:
Thrombin(Leu-Val-Pro-Arg▼Gly-Ser),
Enterokinase(Asp-Asp-Asp-Asp-Lys▼),
rTEV(Glu-Asn-Leu-Tyr-Phe-Gln▼Gly)。
普健生物蛋白纯化技术服务内容:
-
标签特异亲和纯化:His、GST、MBP、Strep、Flag
-
离子交换纯化
-
肝素柱纯化
-
疏水层析
-
凝胶过滤层析
-
蛋白鉴定:SDS-PAGE,HPLC,WB,蛋白浓度检测,吸收光谱


 联系我们
联系我们





