微管是细胞骨架的主要组成部分,在细胞生理活动的各阶段都起重要作用。其主要功能包括:构成细胞骨架,支持和维持细胞的形态;参与物质运输;参与细胞信号转导;调节细胞分裂等。
微管由微管蛋白(tubulin)和微管结合蛋白(MAPs)组成。微管蛋白是球形分子,通常由α-微管蛋白和β-微管蛋白紧密结合成异二聚体,作为微管组装的亚基。α-和β-微管蛋白各有一个GTP结合位点,位于α-微管蛋白上的GTP结合位点是不可逆结合位点,结合上去的GTP被α-和β-微管蛋白单体包围,不能被水解,也不能被游离的GDP替换。但与β-微管蛋白上的GTP结合位点相结合的GTP暴露在微管表面,可被水解成GDP,是可逆结合位点。结合有GTP的微管蛋白趋向于形成微管,而结合GDP的则倾向于从微管中解离,在聚合和解聚过程中构成一种动态循环。这种微管和微管蛋白间的动态平衡,是细胞正常有丝分裂所必需的。
微管与细胞的许多生理功能密切相关,而微管系统的动态平衡为细胞许多生理功能所必需。微管网的重组为细胞生命周期和细胞分裂功能所必需;微管正常排列的破坏及数量的增减与细胞的恶性増殖有关。
微管蛋白与肿瘤
肿瘤细胞具有快速增殖能力,其有丝分裂过程频繁且细胞周期比正常细胞短。因此,若微管组装、去组装的动态循环被打破,必将影响肿瘤细胞的有丝分裂过程,使其生长受到抑制并凋亡。
α-微管蛋白作为微管的重要组成成分,在细胞有丝分裂和染色体分离中起关键作用,并能影响肿瘤细胞的增殖,成为新的抗肿瘤药物的靶点。其通过酪氨酸化和去酪氨酸化,乙酰化和去乙酰化作用的影响,进一步影响肿瘤的发生、迁移和预后。
α-微管蛋白的去酪氨酸化
目前,关于微管蛋白的酪氨酸化的分子机制已研究的比较清楚,然而微管蛋白的去酪氨酸化尚不明确。2019年7月19日,华中农业大学刘主教授课题组在《Nature Communications》发表了题为“Structural basis of tubulin detyrosination by VASH2/SVBP heterodimer”的论文,阐明了VASH2/SVBP复合物切割微管蛋白C末端酪氨酸的分子机制。这项研究中,结合晶体学、分子动力学模拟、小角X光散射等多种生物物理手段,深入研究了VASH2/SVBP复合物作用于微管蛋白并对其去酪氨酸化的分子机理。该研究完善了人们对微管蛋白的酪氨酸化/去酪氨酸化循环机制的理解,有助于靶向于微管蛋白去酪氨酸化新药物的设计与开发。
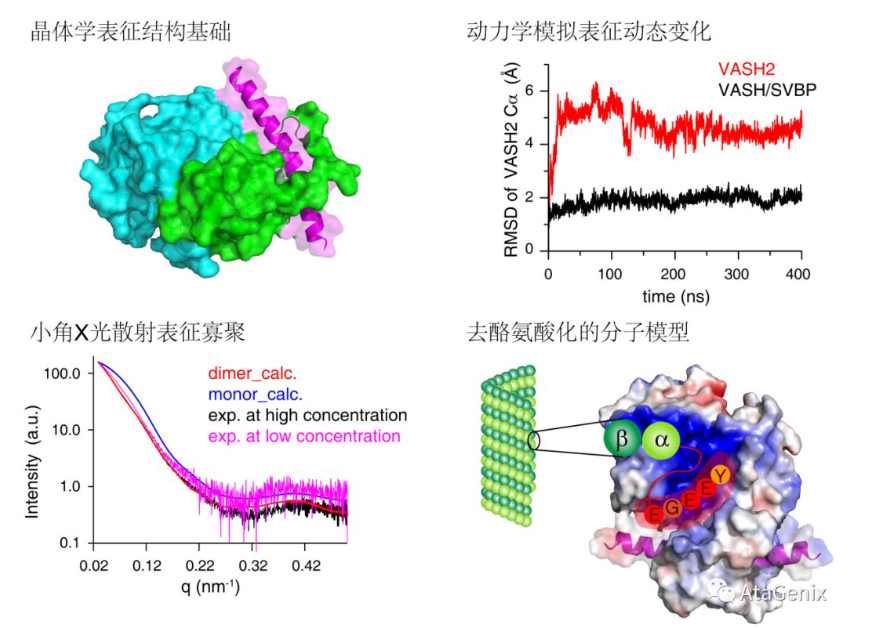
大量研究表明,酪氨酸连接酶(TTL)可催化α-微管蛋白的酪氨酸化,酪氨酸羧肽酶(TTCP)通过移除α-微管蛋白末端的酪氨酸催化微管蛋白的去酪氨酸化。细胞的正常转运过程,α-微管蛋白的去酪氨酸化发挥重要作用。人们现已发现一些肿瘤组织的浸润前沿含有大量的去酪氨酸化微管蛋白,在此期间,癌细胞迁移最为活跃。因此,筛选出具有发生去酪氨酸化的微管蛋白的细胞,可能对肿瘤的发生、迁移和预后研究具有重要意义。
so,如何筛选是关键。
anti-Detyrosinated alpha tubulin mouse monoclonal antibody

WB
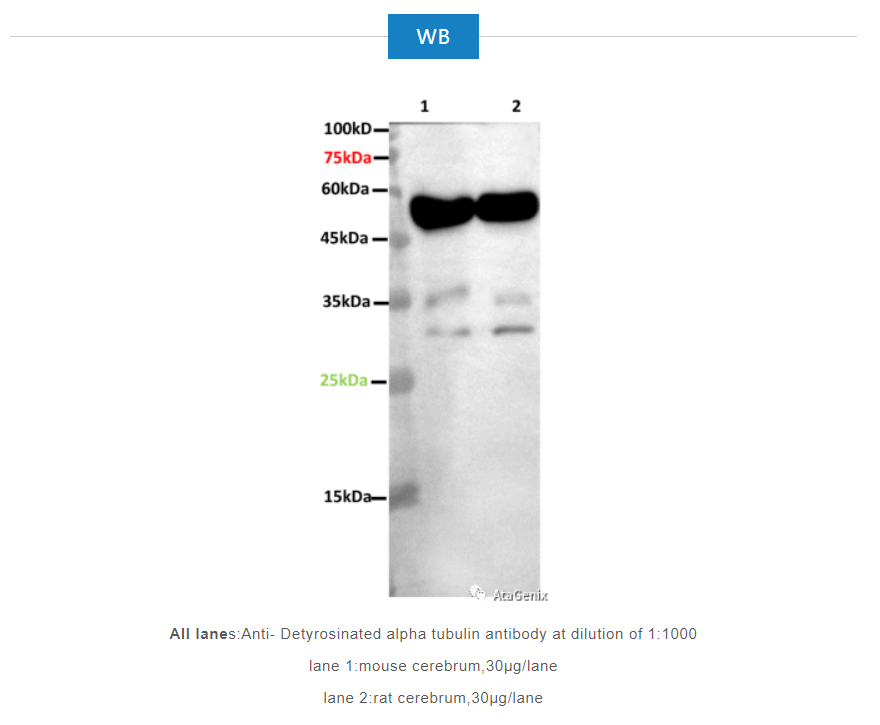
All lanes:Anti- Detyrosinated alpha tubulin antibody at dilution of 1:1000
lane 1:mouse cerebrum,30μg/lane
lane 2:rat cerebrum,30μg/lane
IF
a-Rat cerebellum-DAPI staining
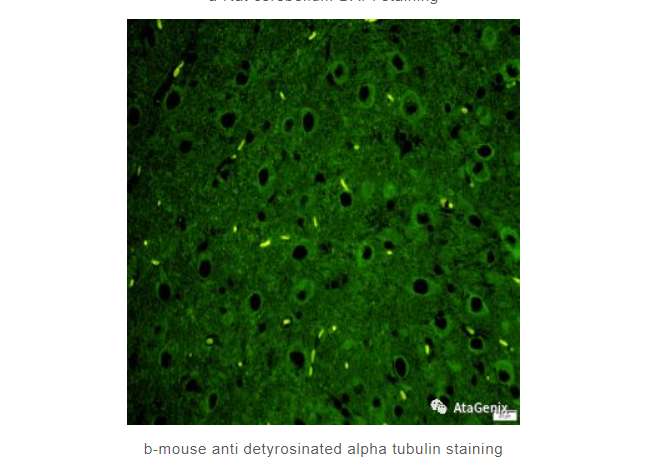
b-mouse anti detyrosinated alpha tubulin staining
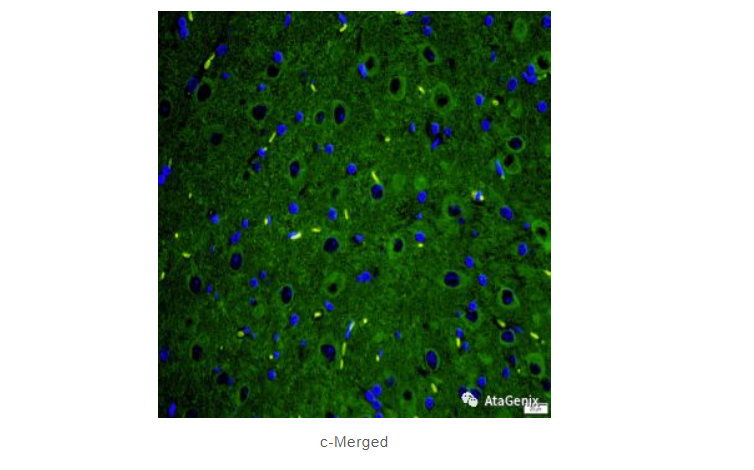
c-Merged
杂交瘤技术生产的TUBA3鼠单抗在大鼠小脑组织石蜡切片的IF验证结果。
版权声明
版权为Atagenix所有。欢迎个人转发分享。其他媒体、网站如需转载或引用本网版权所有内容需获得授权且在醒目位置注明“转自:Atagenix”。

 联系我们
联系我们





