分类:
瞬时转染(transient gene expression, TGE)和稳定转染(stable gene expression,SGE)两种。
指外源 DNA或RNA 转入宿主细胞后不整合到宿主染色体中进行外源目的基因的表达。
特点:
1.目的基因未整合到染色体上,超螺旋质粒DNA有较高的转染效率;
2.转染24h-72h后常需要用到一些报告系统如荧光蛋白、β半乳糖苷酶等来帮助检测;
3.表达持续时间48-72h,随细胞分裂而稀释直至丢失;
4.用于快速分析:如基因产物短期表达、蛋白质小规模表达纯化。
指外源DNA转入宿主细胞后将外源目的基因整合到宿主染色体中进行表达。
特点:
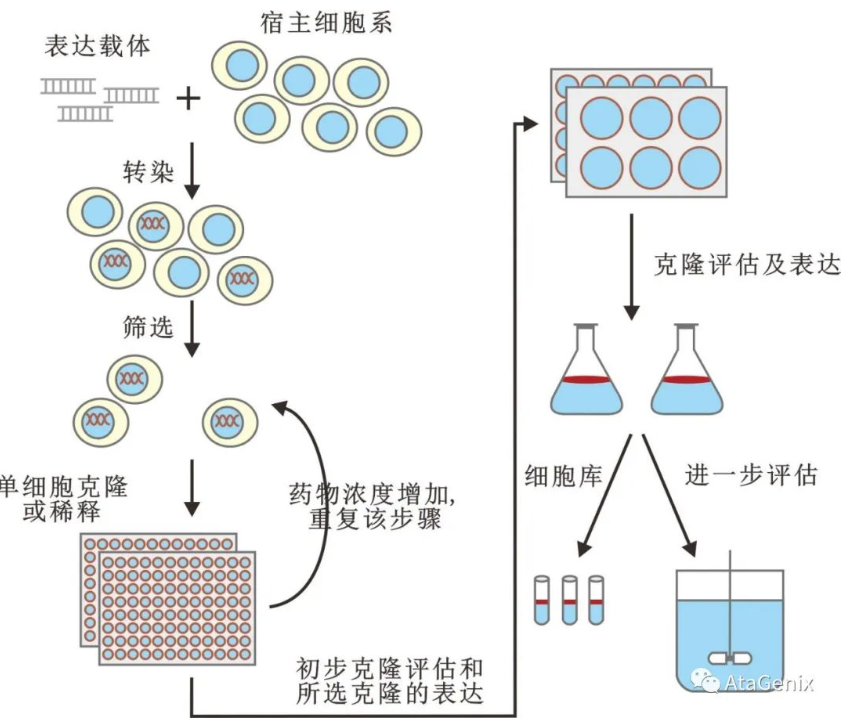
图1 细胞转染流程图
细胞转染的方法
物理法:电穿孔法、显微注射法和基因枪法;
化学法:磷酸钙共沉淀法、脂质体转染方法、多种阳离子物质介导;
生物法:病毒介导转染、逆转录病毒、腺病毒。
一些转染方法方法的比较
|
转染 方法 |
原理 |
应用 |
特点 |
|
电穿孔法 |
高脉冲电压破坏细胞膜点位,DNA通过膜上形成的小孔导入 |
瞬时转染 所有细胞 |
胞用量大,需要根据不同细胞类型优化电穿孔实验条件 |
|
显微注射法 |
用显微操作将DNA直接注入靶细胞核 |
稳定转染 瞬时转染 |
转染细胞数有限,多用于工程改造或转基因动物的胚胎细胞 |
|
基因枪法 |
将DNA用显微重金属颗粒沉淀,再将包被好的颗粒用弹道装置射入细胞,DNA在胞内逐步释放表达 |
瞬时转染 稳定转染 |
用于人的表皮细胞,纤维原细胞,淋巴细胞及原代细胞 |
|
磷酸钙法 |
磷酸钙DNA复合物吸附细胞膜被细胞内吞 |
稳定转染 瞬时转染 |
不适用于原代细胞,操作简便但重复性差,有些细胞不适用 |
|
阳离子脂质体法 |
带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞 |
稳定转染 瞬时转染 所有细胞 |
实用性广,转染效率高,重复性好,但转染时需要除血清。转染效果随细胞类型变化大 |
|
病毒介导法 |
通过侵染宿主细胞将外源基因整合到染色体中 |
稳定转染 |
可用于难转染的细胞、原代细胞,体内细胞等 |
|
逆转录病毒 |
通过病毒中膜糖蛋白和宿主细胞表面的受体相互作用而进入宿主细胞,之后反转入酶启动合成DNA并随机整合到宿主基因组中。 |
特定宿细胞 |
携带基因不能太大,细胞需要处于分裂期,需考虑安全因素 |
|
腺病毒 |
通过侵染宿主细胞将外源基因整合到染色体中 |
瞬时转染特定宿主细胞 |
可用于难转染的细胞,需要考虑安全因素 |
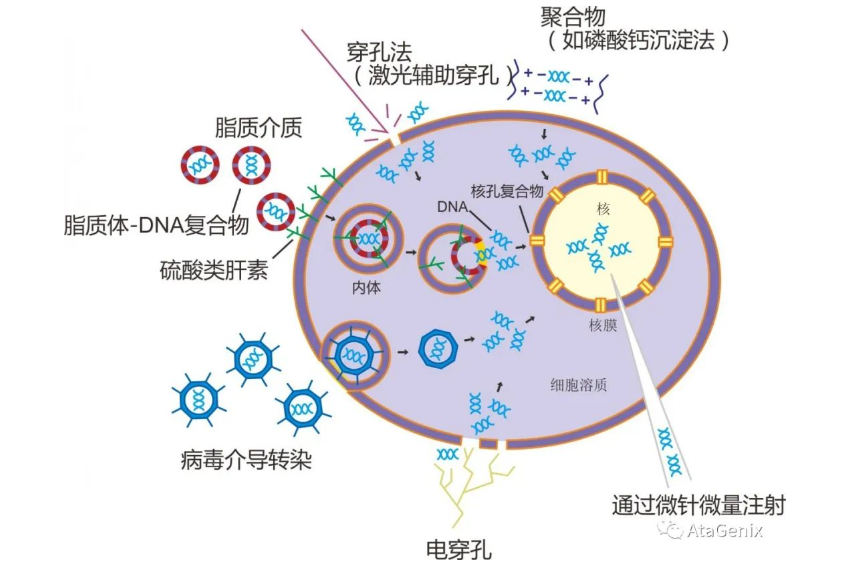
图2 细胞转染的一些常见方法
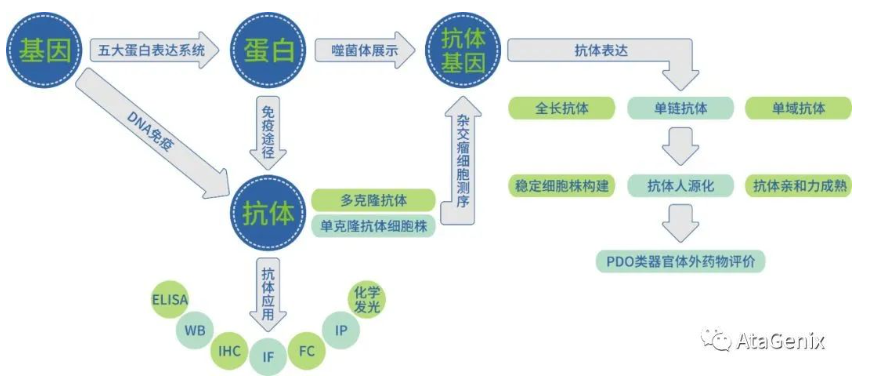
稳定细胞株:一般是将外源DNA克隆到具有某种抗性或者选择基因的载体上,载体被转染到宿主细胞并整合到染色体中,用载体中所含的选择标志进行筛选,筛选得到可稳定表达目的蛋白的细胞株。
1. 基因过表达、突变、沉默等科研用稳转细胞株构建;
2. 重组抗体,细胞因子等生物药的稳转细胞系前期筛选。
1. 重组表达质粒构建(1周)
2. 药物本底浓度测定(2周,可与1同时进行)
3. 细胞转染(1天)
4. 多克隆稳定细胞株筛选及鉴定(2-3周)
5. 单克隆稳定细胞株筛选及鉴定(3-4周)
6. 稳转细胞株产量、活性检测及稳定性研究(根据客户需求)
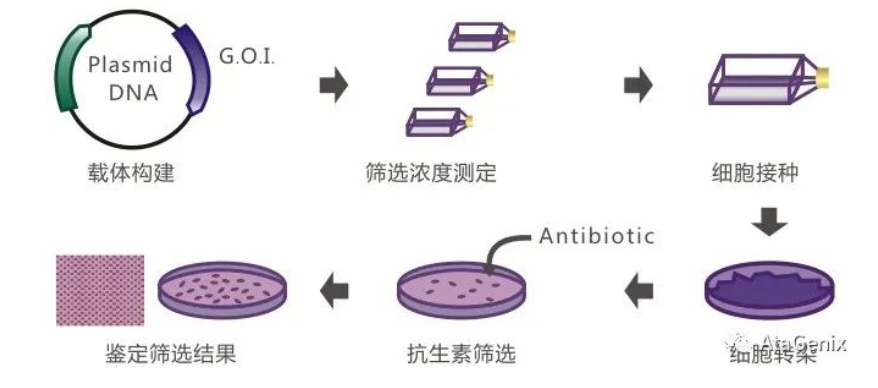
图3 技术流程图
高质:外源基因严格鉴定,细胞来源清晰,无污染
高产:重组蛋白/抗体表达量可快速优化至2g/L以上稳定表达
稳定:独有的GS稳转系列载体配合MSX药物筛选,实现稳定传代15代以上
快速:筛选高产细胞株,周期短至3个月
灵活定制:可针对重组蛋白/抗体全长或片段进行个性化表达
经验丰富:专业的技术团队,已成功为国内外多家医药公司和研究单位构建交付稳定细胞株
多筛选系统:G418/潮霉素/嘌呤霉素筛选系统,GS/DHFR 筛选孵化系统等
案例
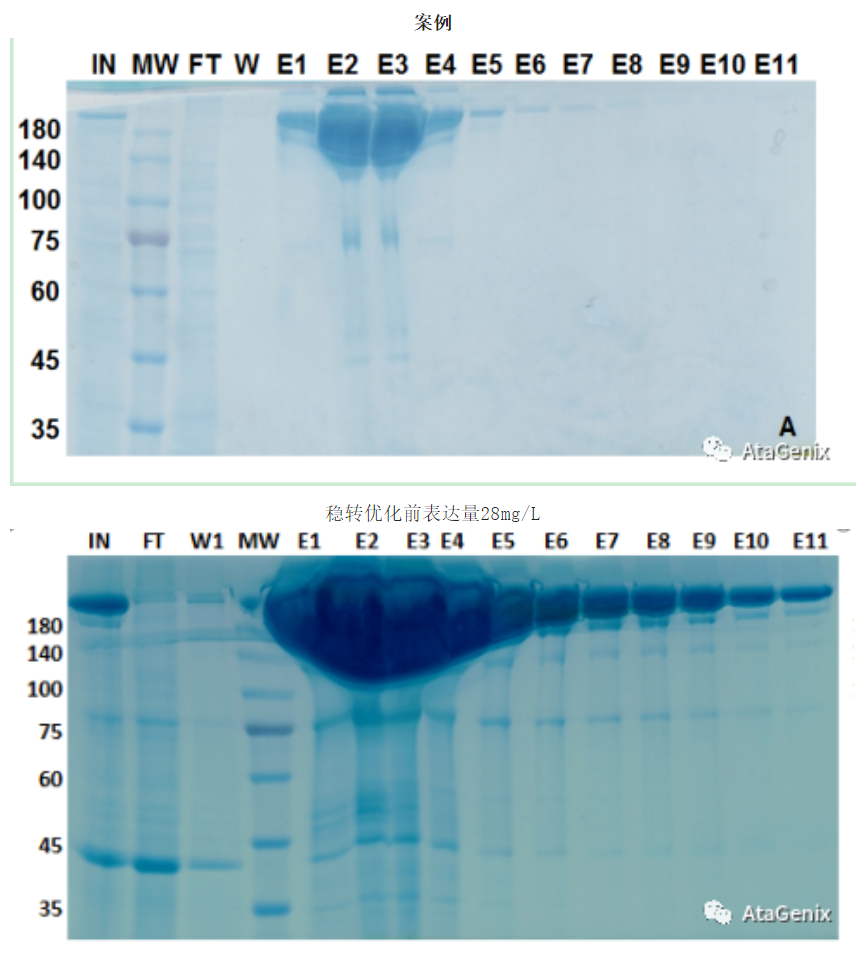
稳转优化前表达量28mg/L;稳转优化后表达量2.3 g/L

 联系我们
联系我们





