LACTB蛋白全称为β-内酰胺酶状丝氨酸蛋白酶,多分布于线粒体内部且广泛表达于哺乳动物组织。LACTB蛋白因其在线粒体中可自发性形成多聚体,多以链状形态游离在线粒体内外膜间隙中。近年来,已有诸多研究表明,LACTB蛋白表达受多种生物学过程影响,但其具体结构与功能机制还处于研究初期,对于LACTB蛋白结构的解析或可为其生理功能研究提供新的方向。
由清华大学领衔的研究团队在《Structure》上发表相关研究《Structural basis for the catalytic activity of filamentous human Serine beta-lactamase-like protein LACTB》。该研究首次揭示了人源线粒体内LACTB蛋白结构和LACTB蛋白催化机制。

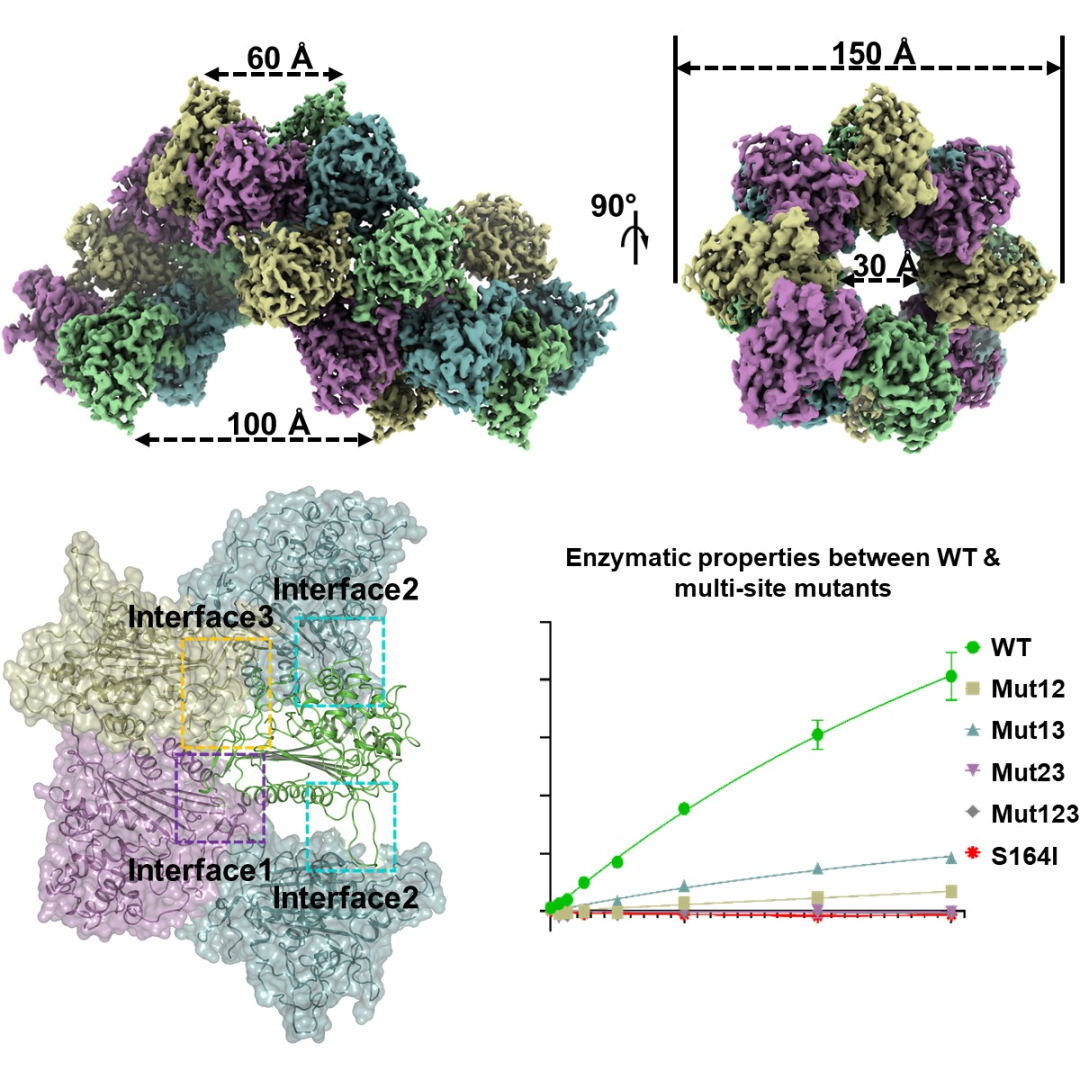
此次研究主要以人源线粒体内成链状丝氨酸蛋白酶LACTB野生型为研究对象。研究发现,当破坏LACTB单体蛋白之间的三种相互作用界面时,会通过抑制该蛋白酶活中心正电平面的强化过程或破坏底物/产物的潜在通道来影响该酶的反应动力学常数。研究人员还发现,在LACTB蛋白与抑制剂Z-AAD-CMK结合状态下,Z-AAD-CMK通过天冬氨酸羰基碳与LACTB蛋白的164位丝氨酸侧链羟基氧共价连接。
另外,研究人员针对LACTB蛋白进行了蛋白链状结构分析和LACTB截短体蛋白的结构分析,
LACTB蛋白鉴于其灵活性很难获取到中间区域密度;而中间区域缺失的LACTB截短体蛋白不仅可保持PBP-βLs结构形式不变,并且其形成多聚的形式也变化不大。随后,研究人员针对LACTB截短体蛋白进行了功能性实验验证,结果表明,LACTB截短体蛋白对其底物Ac-YVAD-AMC多肽的水解活性丧失。这说明,LACTB蛋白的中间区域对其基本PBP-βLs结构的维持及多聚成链中发挥作用不大,但在LACTB蛋白发挥底物水解功能时起到了至关重要的作用。
该研究对于理解LACTB蛋白多聚链状结构与其酶活功能之间的关系具有重要意义,为后续LACTB蛋白相关疾病的致病机理研究铺平了道路,并为今后治疗与LACTB蛋白相关的癌症提供了研究方向及为药物设计靶点提供了重要依据。
相关论文信息:
https://doi.org/10.1016/j.str.2022.02.007
参考文献
1.Keckesova, Z., et al., LACTB is a tumour suppressor that modulates lipid metabolism and cell state. Nature, 2017. 543(7647): p. 681-686.

 联系我们
联系我们





