Selli等人发现,虽然携带CD28的嵌合抗原受体(CAR)T细胞通过肿瘤或慢性感染刺激下发生的经典事件,从而发生功能障碍和耗竭,但携带4-1BB的CAR-T细胞则以由转录因子FOXO3驱动的不同方式发生功能障碍。
十多年前,CAR-T细胞被证明对B细胞恶性肿瘤具有显着的疗效。它们均靶向B细胞分子CD19,并带有CD28或4-1BB中1个共刺激分子的胞内信号域。研究者假设将共刺激结构域并入CAR可改善持久性和功能,从而改善抗肿瘤作用。由于这些初始产品取得显著的初步成功,美国食品和药物管理局批准的所有6种构建物,包括针对骨髓瘤浆细胞表达的b细胞成熟抗原的构建物,以及临床开发中的大多数其他CAR,包括各种适应症,都包含这两个信号域中的一个。
由于CAR以高亲和力识别抗原,并且由组成型启动子表达,因此研究者早期注意到,抗原的持续刺激(有时甚至是CAR的高水平表达)可导致T细胞功能障碍。这些功能失调的T细胞在抗原刺激后的细胞毒性、细胞因子产生和增殖能力降低;这可以通过中断信号转导中的休息来克服。在患者中,高肿瘤负荷与应答降低和T细胞功能障碍增加相关。到目前为止,这种功能障碍被认为在本质上与T细胞“耗竭”是相同的现象,而T细胞“耗竭”已经在接受检查点阻断治疗的慢性病毒感染和癌症中得到了广泛描述。
Selli等通过重复体外刺激携带CD28或4-1BB胞内信号域的CD19导向的CAR T细胞来模拟慢性激活,从而产生功能障碍,然后对转录、表观遗传和表型程序进行了全面分析。每48小时用低效靶比的新肿瘤细胞刺激CAR T细胞。2周后,CAR T细胞失去了杀伤抗原阳性靶点的能力,不能再产生细胞因子,也不能再增殖。接下来,他们利用飞行时间的多参数细胞测定法从表型上研究了这些功能失调的CAR T细胞。研究发现,含有CD28的CAR - T细胞具有典型T细胞耗竭的特征,包括PD-1、TIGIT、LAG3、TIM3和CTLA4的重新表达(见图)。相比之下,携带4-1BB CARs的功能失调T细胞占据不同的T分布随机邻居嵌入空间,其表面表达更高的CD62L和CD25。使用RNA测序检查这些功能失调的CAR T细胞的转录程序显示,基于CD28的CAR T细胞高度富集与耗竭相关的基因,而基于4- 1BB的功能失调的CAR T细胞没有典型的耗竭标签。
最近关于T细胞衰竭的研究强调,这种状态是由特定的表观遗传改变决定的。研究人员还使用染色质开放性测序技术(ATAC-seq)证实了这些差异,特别是PD1编码基因(PDCD1)的染色质可及性测定法,在基于CD28的CAR T细胞中,这看起来像是典型的耗竭,但在基于4- 1BB的CAR T细胞中并非如此。研究人员随后使用纵向单细胞RNA测序,确定大多数功能失调的4-1BB CAR T细胞是由一组涉及细胞毒性(GNLY、CCL5、PRF1、GZMA、GZMK、CTSW)、自然杀伤细胞特性(KLRK1、KLRC2)和T细胞分化(ID2)的独特基因定义,他们将这些基因称为TBBD标签。有趣的是,他们的TBBD标签在接受抗CD19 /4- 1BB CAR构建物Tisagenlecleucel治疗的1例患者中得到了证实,该患者虽然血液中有CAR T细胞,但淋巴瘤仍发生进展。
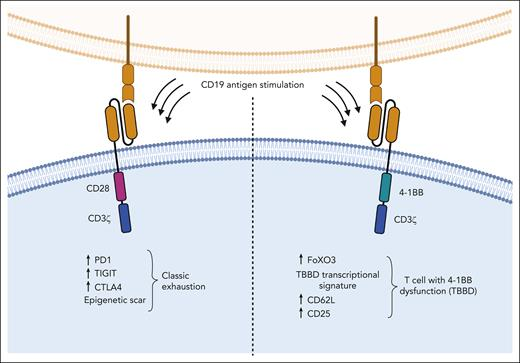
携带不同共刺激结构域的CAR-T细胞在慢性刺激后功能失调时表现出不同的转录、表观遗传和表型特征。携带4-1BB共刺激结构域的CAR-T细胞重新激活FOXO3,其驱动一种不同于经典T细胞衰竭的新功能障碍程序。
为了了解这种功能障碍的新型分子程序的起源,研究团队研究了随着时间的推移转录因子结合的可及性。正如预期的那样,CD28-CAR功能障碍增加了Jun:Fos(AP1)结合的可及性,但相反,4-1BB-CAR功能障碍打开了同源盒(HOX)和叉头框(FOX)位点,并且小的条理性RNA测序数据显示FOXO3活性高。此外,在机制研究中,通过CRISPR/Cas干扰FOXO3可使患者对重复抗原刺激后的功能障碍产生抵抗,相反,FOXO3过表达显著减少了4-1BB(而非CD28) CAR T细胞在重复抗原刺激下的扩增。在小鼠异种移植应激模型中,注射极少量的CAR T细胞治疗较高的肿瘤负荷,携带4-1BB胞内信号域的FOXO3敲除CAR T细胞改善了生存。
值得注意的是,研究人员通过深度技术探究(从高维细胞测定到纵向单细胞RNA测序)发现了一种新的分子机制,同时仍然使用相对简单的体外模型(重复抗原刺激)。分子程序本身和FOXO3的重新激活是有趣的,可能在自然界中并不常见。在自然生物学中,4-1BB刺激与T细胞受体(TCR)刺激在时间上分离,而TCR表达本身随着抗原暴露而循环,因此减少了紧张信号传导的可能性。未来的研究可能包括在更多接受Tisagenlecleucel治疗但无应答的患者中进一步验证TBBD转录特征和FOXO3活性。同样,无论疾病状态如何,我们都应基于对新生CD19+ B细胞的长期暴露,进一步了解Tisagenlecleucel在患者中是否会耗竭。有趣的是,在接受治疗的前2例患者(这2例患者均有长期缓解)中,长期暴露于新生B细胞被认为在Tisagenlecleucel持续10年的过程中发挥了作用。此外,当BCMA阳性骨髓瘤患者在使用BCMA导向的CAR T细胞持续存在的情况下复发时,对于对其他抗原具有特异性的、携带4- 1BB的CAR T细胞(例如已批准用于多发性骨髓瘤的两种靶向B细胞成熟抗原[BCMA]的CAR T细胞)是否也表现出TBBD标签和FOXO3再激活,这将是该领域的兴趣。最后,在机制水平,研究FOXO3敲除或C-Jun过表达在减少CAR-T细胞耗竭方面是否更有效将是有趣的。
参考文献
1.Selli ME, Landmann JH, Terekhova M, et al. Costimulatory domains direct distinct fates of CAR-driven T-cell dysfunction. Blood. 2023;141(26):3153-3165.
2.Kochenderfer JN, Dudley ME, Feldman SA, et al. B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells. Blood. 2012;119(12):2709-2720.
3.Porter DL, Levine BL, Kalos M, Bagg A, June CH. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med. 2011;365(8):725-733.
4.Brentjens RJ, Davila ML, Riviere I, et al. CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Sci Transl Med. 2013;5(177):177ra38.
5.Weber EW, Parker KR, Sotillo E, et al. Transient rest restores functionality in exhausted CAR-T cells through epigenetic remodeling. Science. 2021;372(6537):eaba1786.
6.Locke FL, Rossi JM, Neelapu SS, et al. Tumor burden, inflammation, and product attributes determine outcomes of axicabtagene ciloleucel in large B-cell lymphoma. Blood Adv. 2020;4(19):4898-4911.
7.Blank CU, Haining WN, Held W, et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 2019;19(11):665-674.
8.Sen DR, Kaminski J, Barnitz RA, et al. The epigenetic landscape of T cell exhaustion. Science. 2016;354(6316):1165-1169.
9.Melenhorst JJ, Chen GM, Wang M, et al. Decade-long leukaemia remissions with persistence of CD4(+) CAR T cells. Nature. 2022;612(7941):E22.
10.Lynn RC, Weber EW, Sotillo E, et al. c-Jun overexpression in CAR T cells induces exhaustion resistance. Nature. 2019;576(7786):293-300.

 联系我们
联系我们





