促进减肥的热量限制是治疗非酒精性脂肪性肝病和改善2型糖尿病患者胰岛素敏感性的有效策略。尽管它有效,但在大多数人中,体重减轻通常不会维持,部分原因是抑制能量消耗的生理适应,这一过程称为适应性产热,其机制基础尚不清楚。用重组生长分化因子15 (GDF15)喂养高脂肪饮食的啮齿动物可减少肥胖并改善血糖控制,通过神经胶质细胞衍生的神经营养因子家族受体α样(GFRAL)依赖性抑制食物摄入来改善血糖控制。研究发现,除了抑制食欲外,GDF15还抵消了能量消耗的补偿性减少,与单独的热量限制相比,引起更大的体重减轻和非酒精性脂肪性肝病(NAFLD)的减少。GDF15在卡路里限制期间维持能量消耗的这种作用需要一个GFRAL-β-肾上腺素能依赖性信号轴,该信号轴增加小鼠骨骼肌中的脂肪酸氧化和钙徒劳循环。这些数据表明,GDF15-GFRAL通路的治疗靶向可能有助于在热量限制期间维持骨骼肌的能量消耗。

GDF15在肝脏和肾脏中高表达,并在所有细胞类型中诱导,以响应线粒体毒素和内质网应激。GDF15首次被确定为巨噬细胞分泌的可溶性因子和癌细胞后来被证明会诱发恶病质,并保护小鼠免受肥胖和胰岛素抵抗。在喂食高脂肪饮食的啮齿动物中,用重组GDF15治疗可减轻体重,减少肝脂肪变性并改善血糖控制。这些减肥效果已被证明需要后脑。更具体地说,GDF15受体GFRAL在跨越7-10天的短期实验中,载体处理小鼠的配对喂养(热量匹配)表明,GDF15引起的体重减轻是由于食物摄入量减少。重要的是,种系Gdf15-null小鼠,肝脏靶向Gdf15-空小鼠和种系Gfral-null小鼠,当喂食高脂肪饮食时,所有人都有适度增加的食物摄入量和肥胖,支持该途径在调节能量平衡中的生理作用。这些研究得出的概念是,通过GFRAL的GDF15信号减少体重并改善血糖控制,主要是通过抑制食欲,同时对能量消耗的影响最小。
肥胖是由能量摄入和消耗之间的热量失衡引起的。尽管GDF15抑制啮齿动物和非人灵长类动物的能量摄入是众所周知的,在得出结论这是导致减肥的唯一机制之前,需要考虑三个重要的区别。首先也是最重要的是,能量摄入、能量消耗和体重是相互关联的相互依赖的变量,它们相互动态地联系在一起,因为能量摄入的减少和体重减轻都会导致能量消耗的减少。其次,在Gfral-null小鼠中进行重组GDF15的研究在相对较短的时间内(7-10天),这可能不足以检测与减少能量消耗(即适应性产热)相关的反调节反应,这些反应通常在长时间的热量限制后发生在啮齿动物中。最后,现在认识到在室温(21°C)下饲养的小鼠中进行能量平衡实验,该实验低于啮齿动物的热中性区,刺激交感神经驱动。这可能会抑制诱导徒劳循环或通过β肾上腺素能信号通路刺激能量消耗的药物引起的体重减轻。总的来说,这些研究表明,在研究小鼠的体重减轻和药物干预时,考虑热量摄入、干预持续时间和住房温度之间的相互关系非常重要。
为了更好地了解GDF15可能促进减肥的机制,我们研究了以热中性(29°C)饲养的小鼠,这些小鼠被喂食高脂肪和果糖的西式饮食,促进肥胖,胰岛素抵抗和非酒精性脂肪性肝炎(NASH),其病理,组织学和转录特征与人类疾病发展相似。由于小鼠的肝脏脂肪变性对热量摄入的变化非常敏感,我们假设,鉴于天然人GDF1的半衰期短(小鼠2小时),光周期开始时(小鼠摄入较少卡路里的时间段)的治疗对食物消耗的影响将小于我们之前的研究,当时在黑暗周期开始时注射小鼠。与该假设一致,与载体处理的对照组相比,在光周期开始时用GDF15(每公斤5nmol)注射小鼠导致每日食物摄入量减少30%,而黑暗周期开始时减少43%(差异约40%;扩展数据图随后,我们在光周期开始时每天一次向小鼠注射载体或重组GDF1,三种不同剂量(每公斤15.0,3和1nmol),持续5周。每天测量个体食物摄入量,并与配对喂养的对照相匹配。注射GDF6迅速且剂量依赖性地升高了GDF15的血清水平,然后在黑暗周期开始时下降到基线。正如预期的那样,GDF15的长期日常治疗导致食物摄入量的剂量依赖性减少,与先前使用相同的重组蛋白制剂的观察结果一致。
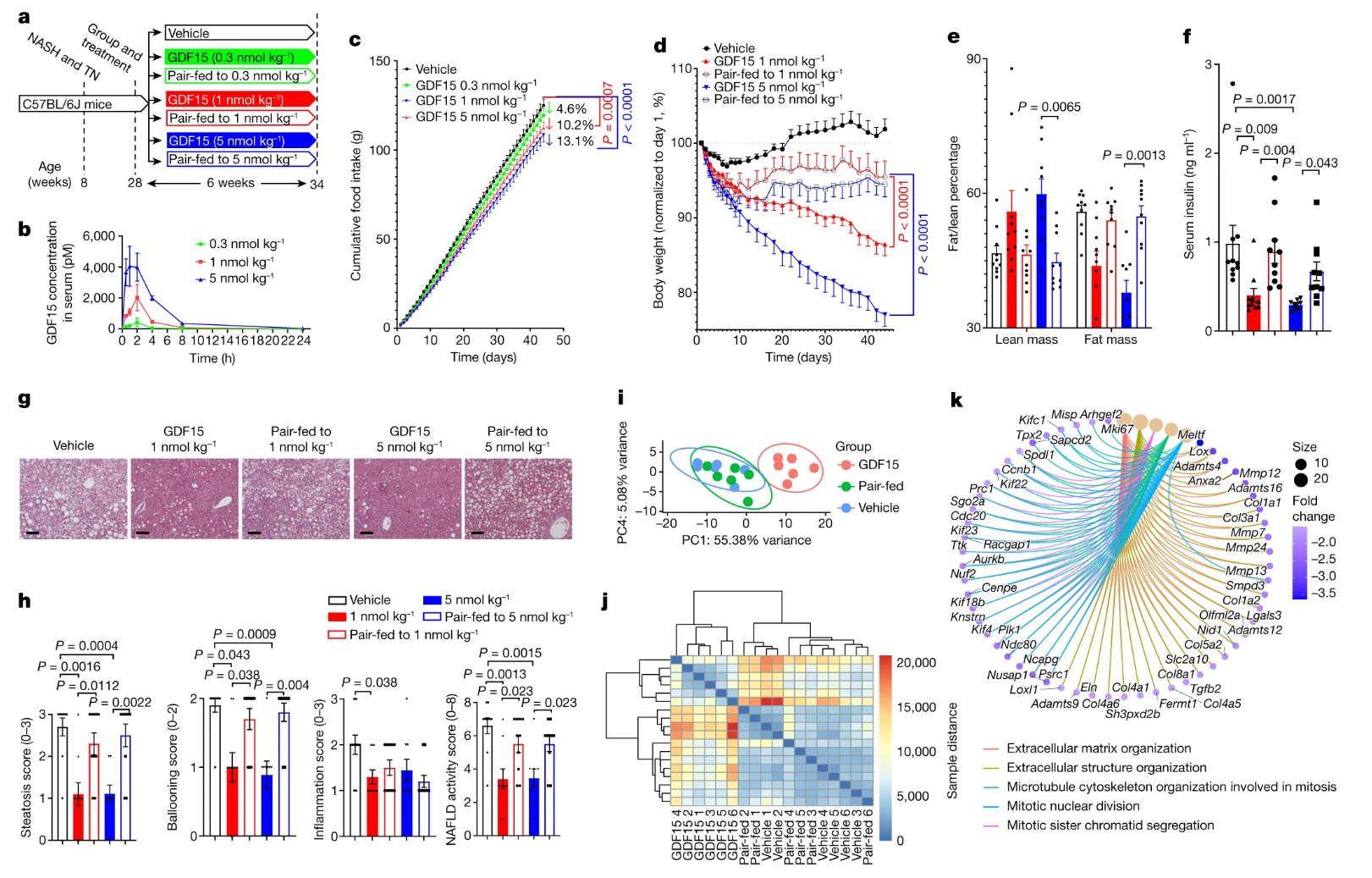
与载体处理或配对喂养的对照相比,以每公斤15.0nmol提供的GDF3没有显着降低体重。当GDF15以每公斤1和5nmol的速度给药时,前10天,GDF15治疗和成对喂养对照之间的体重减轻轨迹相似,反映了这段时间内以前的实验和扩展数据图。然而,2天后,成对喂养的对照组的体重没有进一步减少,而GDF10处理的小鼠继续减肥和扩展数据图到实验结束时,用GDF1以每公斤2和15nmol处理的小鼠分别损失了1.5%和13.6%的体重,而配对喂养的对照小鼠的体重约为23%。
重要的是,这种体重减轻归因于脂肪量的减少,而不是体重的减少。已知这对维持能量消耗很重要。与体重和肥胖的减少一致,GDF15在每公斤1和5nmol时降低了血清胰岛素,而与载体处理的对照相比,GDF15每公斤5nmol改善了葡萄糖耐量和胰岛素敏感性。这些数据表明,GDF15在慢性环境中促进体重减少,降低胰岛素抵抗的程度比单独的热量限制更大。
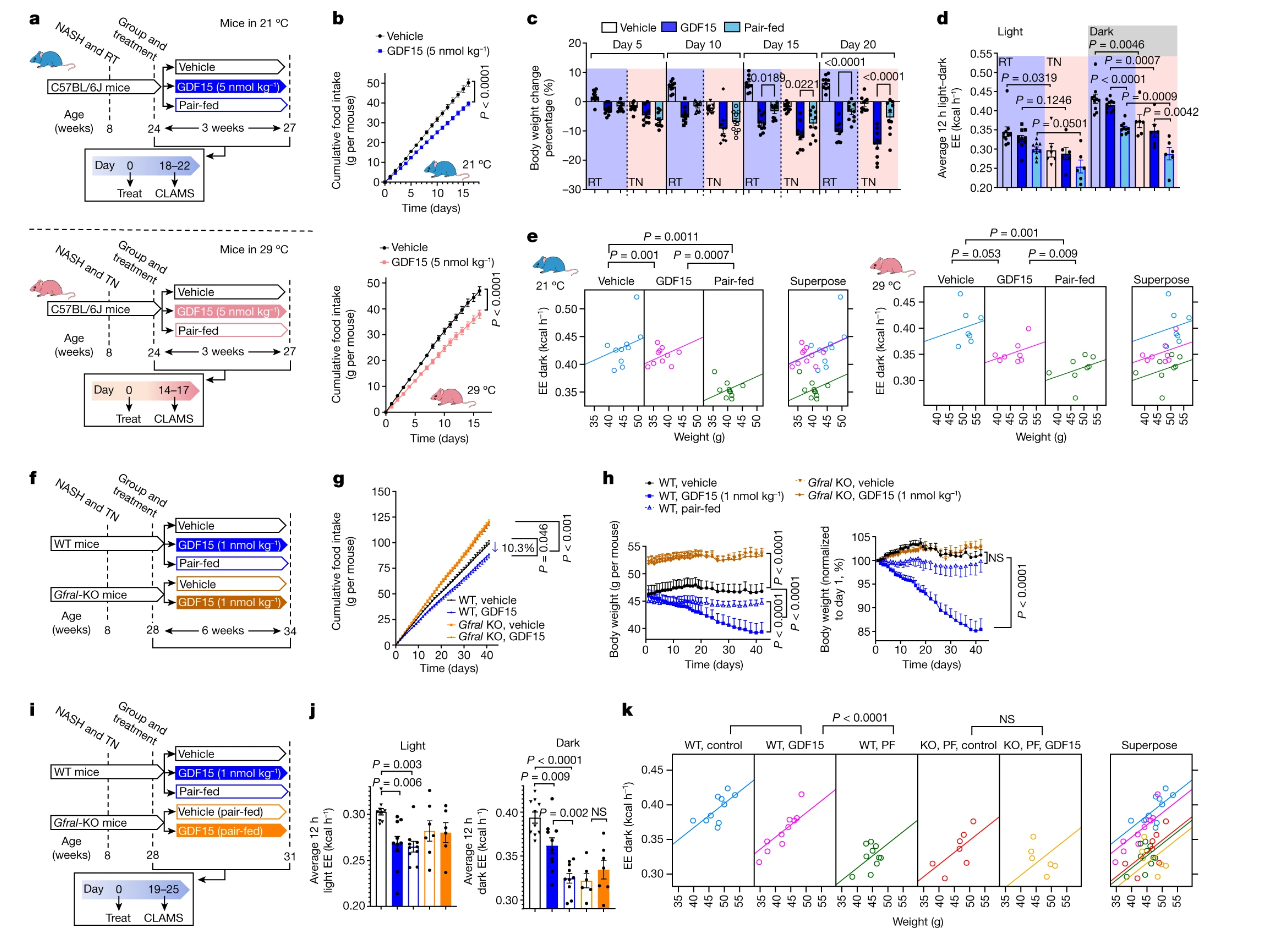
GDF15通过GFRAL增加能量消耗并减少体重
a, Experimental schematic. Mice were housed at room temperature (RT; 21 °C) or thermoneutrality (TN, 29 °C). CLAMS,Comprehensive Laboratory Animal Monitoring System. b, Cumulative food intake. Data are mean ± s.e.m. n = 10 mice per group at room temperature. n = 7 mice per group at thermoneutrality. P values were calculated using two-way ANOVA with Tukey’s multiple-comparison test. c, Percentage body weight change. Data are mean ± s.e.m. n = 10 mice per group. P values were calculated using one-way ANOVA with Tukey’s multiple-comparison test. d, Average energy expenditure. Data are mean ± s.e.m. n = 10 mice per group at room temperature. n = 6 mice per group at thermoneutrality. P values were calculated using one-way ANOVA with Šidák’s multiple-comparison test. e, ANCOVA using body mass as a covariate (two-sided without adjustment). n = 10 mice per group at room temperature and n = 6 mice per group at thermoneutrality. f, Experimental schematic for the effect of GDF15 on WT and Gfral-KO mice. EE, energy expenditure. g, Cumulative food intake. Data are mean ± s.e.m. n = 10 mice per group. P values were calculated using two-way ANOVA with Tukey’s multiple-comparison test. h, Body weight and percentage change over time. Data are mean ± s.e.m. n = 10 mice per group. P values were calculated using two-way ANOVA with Tukey’s multiple-comparison test. i, Experimental schematic for the effects of GDF15 and matched caloric restriction on energy expenditure in WT and Gfral-KO mice. j, The average energy expenditure during a 12 h–12 h light–dark cycle. Data are mean ± s.e.m. n = 10 (WT, vehicle; WT, GDF15; and WT pair-fed), n = 7 (KO, pair-fed) and n = 6 (KO, GDF15) mice. P values were calculated using one-way ANOVA with Šidák’s multiple-comparison test. NS, not significant. k, ANCOVA using body mass as a covariate and treatment as a fixed factor (two-sided without adjustment). n = 10 (WT, vehicle; WT, GDF15; and WT, pair-fed (PF)), n = 7 (KO, pair-fed) and n = 6 (KO, GDF15) mice.

 联系我们
联系我们





