随着越来越多的重组抗体应用于传染性疾病中,人们对于此类抗体药物越来越关注,尤其是针对目前尚无疫苗的高危人群和病原体的重组抗体。然而,表现为机会性或潜伏性感染的病原体表达复杂的毒力相关蛋白阵列,并擅长躲避免疫应答。一些病原体已经发展出有选择性地破坏抗体的策略,而另一些则制造诱饵表位,欺骗宿主免疫系统产生抗体,这些抗体轻则没有保护作用,重则推进了发病机制。以重组抗体为代表的抗体工程策略可以通过访问保守的中和表位、生成Fc结构域来阻止捕获或降解,甚至访问隐藏在细胞内的病原体,从而阻碍这些努力。病原体耐药抗体的设计可以增强对这些复杂病原体的保护并指导疫苗免疫原的开发。设计针对特定病原体防御机制的重组抗体可以从三个方面着手:靶向屏蔽脆弱表位的病原体、靶向破坏抗体 FC 功能的病原体、靶向破坏宿主免疫力的病原体,今天我们主要介绍如何针对病原体保护脆弱的抗原表面进行抗体的设计和重组。
针对病原体保护脆弱的抗原表位
抗体靶向的一个关键要求是易于识别病原体相关分子。最佳靶点由不同组织和感染的多个阶段由大多数菌株表达表达,易于获得,这些靶点要么在疾病进展中发挥关键功能,要么募集调理素介导病原体破坏。这为病原体隐藏这些脆弱的表位提供了选择压力。对中和抗体和非中和抗体复合物中病毒糖蛋白的结构-功能研究揭示了抗体逃逸的共同机制,包括抗原漂移、表位屏蔽和免疫向优势但非保护性表位的定向。这些见解结合新的表位特异性和靶点未知的抗体发现工具,支持设计更有弹性的药物性抗体。
结合抵抗抗原漂移的保守表位的抗体
人们在确定靶向包膜病毒(包括RSV、流感病毒、HIV和冠状病毒)保守表位的抗体方面已经投入了大量工作,从而开发出可预防多种毒株的广谱反应性抗体和疫苗。这些病毒利用融合糖蛋白入侵宿主细胞,首先附着在宿主细胞受体上,然后经历巨大的构象变化将病毒和宿主的膜结合在一起并介导膜融合。确定中和抗体的努力集中在受体结合域,以阻断这种初始相互作用。
事实上,这些区域具有高度的免疫原性,结合关键表位的抗体可有效中和。对RSV F融合蛋白进行的重要研究表明,融合前构象比融合后构象包含更多的中和表位,并且这些表位可能在构象变化过程中丢失。抗体D25与融合前位点Ø结合,从而阻断受体结合,中和RSV的效力比目前临床使用的识别融合后表位的抗体(帕利珠单抗)高50倍。D25作为Nirsevimab正在通过临床试验取得进展,其半衰期Fc延长,可以单次给药。
鉴定这种强效抗体对于其他病毒来说一直具有挑战性,部分原因是受体结合域的高度序列变异,这通常会限制抗体的中和作用仅局限于少数毒株。
在SARS-CoV-2中,多种抗体阻断梭原刺突蛋白与ACE2受体获得了紧急使用授权,但由于新变异株的突变而迅速失效。因此需要鉴定参与保守残基的中和抗体,通常在隐秘的表位中,不易受到抗原漂移的影响。纳米抗体在这种情况下特别有用,因为它们的小尺寸和长CDR3环可以进入IgG抗体无法获得的表位,因此不太容易受到人体免疫系统压力引起的抗原漂移的影响。一项针对免疫骆驼的努力确定了数百个CDR3纳米抗体家族,靶向穗峰。其中包括具有皮摩尔亲和力的强效纳米抗体,可在动物模型中中和多种SARS-CoV-1和2毒株,而其高稳定性支持经鼻给药,从而在感染部位达到治疗浓度。为了诱导抗体与保守的中和第4类和1/4类表位结合,用含有来自8株菌株的受体结合域嵌合体的纳米颗粒进行免疫似乎有希望。这一领域的巨大努力凸显了找到中和可变受体结合域的交叉反应性抗体的挑战和前景。
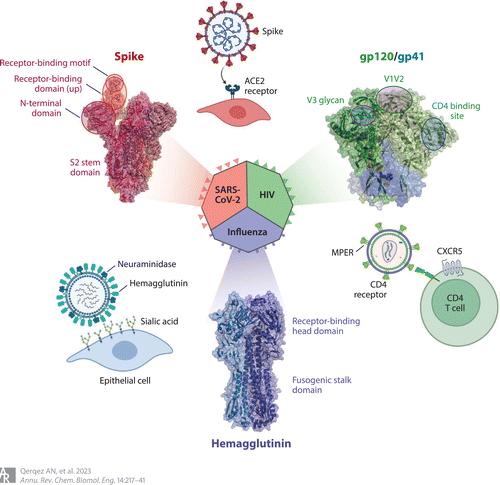
Figure 1 Key domains and antibody-targeted vulnerable sites in viral fusogen proteins from SARS-CoV-2, HIV-1, and influenza. For each virus, the overall interactions with the respective cellular receptor are shown along with the structure of each corresponding fusogen, indicating key domains and epitopes. Structures for influenza hemagglutinin H3 are from PDB 4FNK, for the HIV-1 envelope from PDB 5CJX, and for the SARS-CoV-2 spike from PDB 7SXT. Abbreviation: MPER, membrane-proximal external region. Adapted from images created with BioRender.
鉴定与罕见的、保守的中和表位结合的抗体的另一种方法是鉴定那些与功能受限的表位结合的抗体。在融合糖蛋白中,这包括发生构象变化的高度保守区域,或称为茎、柄或S2域。在一项感染研究中,在流感中,结合该区域的血清抗体与保护作用相关,而且这些抗体似乎不太容易被病毒逃逸大多数中和抗体结合的是血凝素受体结合头结构域内的毒株特异性表位,而与融合柄结合的抗体可通过抑制低ph核内体中膜融合所需的构象重排和招募Fc效应蛋白功能来中和多个病毒群(Figure 1)。Guthmiller等发现了一个高度保守的血凝素锚定表位,该表位在人类B记忆库中常见。结合这一表位的抗体可稳定病毒膜附近的血凝素,从而中和广泛的H1毒株、潜在的大流行H2和H5毒株以及常见的A388V柄逃逸变异株。同样,3A3抗体和7A3纳米抗体均靶向高度保守的β冠状病毒铰链,从而结合广泛的毒株,而且7A3已被证明保护表达ACE2的人小鼠免受Delta SARS-CoV-2感染。结合保守干性表位的抗体可以识别广泛的毒株,但它们对保护作用的贡献尚未完全清楚。
这些成功激发了人们对识别其他靶蛋白(包括复杂细菌病原体表达的蛋白)上高度保守的表位的兴趣。结合细菌表面的保护性抗体可通过Fc受体直接介导吞噬作用或激活补体,导致C3b调理作用,继而吞噬作用或直接溶解细菌。一个关键限制是抗原表面密度必须足够高,以支持触发这些事件所需的抗体和受体聚集。就脑膜炎奈瑟菌而言,每个细胞似乎都需要>757因子H蛋白。目标蛋白也应该是必需的,因为杀菌抗体可导致抗原丢失,正如观察到的蛋白百日咳黏着素(pertactin)一样,许多百日咳鲍特菌疫苗中含有百日咳黏着素。为此,通过筛选人类供体细胞,发现了与保守和保护性肺炎链球菌抗原肺炎链球菌组氨酸三联体蛋白PhtD结合的抗体。这些蛋白与来自几种血清型荚膜细菌的抗原结合,保护小鼠免受原发性和继发性攻击,为单独靶向>100不同荚膜血清型提供了一种潜在的替代方案。同样,莱姆病病原体伯氏疏螺旋体(Borrelia burgdorferi)外表面蛋白VlsE(表达的可变主要蛋白样序列)的保守区域已被确定,但它们的治疗潜力仍有待确定。这些报告令人兴奋,因为它们提示结合细菌表面蛋白的抗体可用于补充结合细菌碳水化合物的抗体。
进入隐藏表位的抗体
抗体可以接触到溶剂暴露的表位,这对抗原漂移产生压力,从而逃避抗体结合。因此,病原体可以遮蔽保守的和功能重要的表位。一种策略是提出高免疫原性但无保护性的诱骗表位,以限制抗体对邻近易损表位的识别。
与这一高度保守的表位结合的抗体很罕见,因为它毗邻一个免疫显性和高可变的环。从免疫原中删除该环可诱导产生高水平IgG22样抗体,从而保护小鼠免受不同β-人冠状病毒的感染。类似地,人巨细胞病毒gB融合原在抗原结构域2中包含一个高度保守的位点1(跨越第69 ~ 78位残基),该位点可诱导产生有效的保护性抗体。该位点被与相邻位点2(跨越残基50 ~ 54)和免疫显性抗原域1结合的抗体有效掩盖,这两个位点都主要引起非中和抗体。根据IgG22报告推断,未来的免疫原设计工作可能能够将免疫应答集中在gB位点1和其他抗原中的次优势但具有保护作用的表位。
第二种策略是使用糖基化位点来屏蔽脆弱的表位。HIV-1包膜被>25 n连接的糖基化位点修饰,这些糖基化位点保护了广泛中和表位,包括V1V2位点,即gp120上的第一个和第二个可变区(图1)。在RV144疫苗的Ⅲ期试验中,V1V2结合抗体介导Fc效应功能(抗体依赖性细胞吞噬和补体激活),而不是广泛中和作用,从而与保护作用相关。该区域在许多供体中引起交叉反应性抗体,但需要广泛的体细胞超突变和长CDRH3环才能访问表位。与先前的结合V1V2的抗体PG9不同,CAP256-VR26抗体系结合V1V2区域,并在耐受刺突聚糖N160和N156丢失的情况下产生了有效的fc介导的保护作用。其他广泛的HIV中和抗体需要多年的成熟和广泛的体细胞超突变,与之不同,CAP256-VRC26.08包含的突变要少得多,这可以简化通过接种疫苗产生类似抗体的策略。
第三种策略是结构阻断易损表位。例如,受体结合表位可仅在需要与受体结合时短暂暴露。SARS-CoV-1/-2 交叉反应抗体CR3022已报告了这一点,该抗体与一个隐表位结合,当受体结合结构域处于下降状态时隐藏,但当该域转变为上状态并与ACE2受体结合时隐表位被暴露。同样,广中和抗HIV抗体3BNC117和10-1074仅在CD4与HIV-1包膜接合以暂时暴露脆弱的CD4结合位点。因此,只有在存在小分子CD4模拟物的情况下,接种HIV-1 gp120变异株的非人灵长类动物对HIV-1感染T细胞的抗体依赖性细胞毒性(ADCC)改善。gp41包膜蛋白的膜近端外部区域引发最广泛的中和单克隆抗体(例如4E10、LN01、VRC42),但这些很少见,因为该表位仅在融合前至融合后的转化过程中短暂暴露。可能需要同时给药两种抗体才能接近某些表位:一种抗体可使靶蛋白稳定在开放状态(例如受体模拟物),另一种抗体可与敏感表位结合。
靶向可变抗原的抗体
上述例子突显了靶向仅需要少数蛋白质就可感染细胞的病毒的易损表位所面临的挑战。将这些策略应用于表达更多表面抗原的细菌病原体会带来额外的挑战,因为在许多情况下,靶点的关键分子并不明显。
鉴于细菌碳水化合物(脂多糖和荚膜多糖)的丰度、可及性和免疫原性,它们一直是主要靶点。事实上,使用脑膜炎奈瑟氏菌血清群A胶囊的糖缀合物接种疫苗几乎消除了该血清群的临床病例。遗憾的是,这些分子也具有高度的变异型:虽然铜绿假单胞菌脂多糖疫苗在动物模型中可诱导保护性免疫,但存在20种以上 o抗原血清型,许多有多个亚型,因此有必要开发血清型特异性治疗方法。
鉴于细菌碳水化合物的多样性和产生针对这些柔性分子的抗体的挑战,保守表面蛋白可能更适合作为抗体靶点。鉴定出一种与大肠杆菌必需外膜输出蛋白BamA结合的抗体,该抗体与一个细胞外环结合,从而破坏BamA功能。抗体结合诱导细菌应激反应,破坏外膜完整性,并在亚纳摩尔浓度(49)下杀死细菌。然而,由于外膜蛋白隐藏在表面碳水化合物之下,因此该抗体仅对具有最小脂多糖结构的菌株有效。
尽管已经鉴定出成功的抗原,如脑膜炎奈瑟氏菌H因子(22)和肺炎链球菌PhtD蛋白,但这些报告凸显了预先选择合适的细菌靶点的挑战。为了替代使用靶向未知方法分离抗体,DiGiandomenico等从感染患者和健康人中鉴定出与完整铜绿假单胞菌细胞结合的抗体,并对其进行调理吞噬细胞杀伤筛选。一组单基因敲除的铜绿假单胞菌分离株表明,所有选择的抗体均结合了表面暴露的多糖Psl,该多糖在多个菌株中保守,并在多种疾病状态下表达。抗ps1铅抗体Cam-003结合了173株铜绿假单胞菌临床分离株中的85%,尽管亲和力仅为144 nM,但在小鼠急性致死性肺炎模型中提供了强大的保护作用。
病原体的适应性需要抗体靶向方法的创新。这可以包括使用来自多个毒株的抗原诱饵来识别针对已知靶点的交叉反应性抗体的抗体发现策略,这种方法已经识别了结合不同病毒表位的一系列抗体。为了将这些方法扩展到更复杂的细菌病原体,靶向未知方法以及随后对所需功能的广泛筛查显示出了希望。
转载说明:本文图文源自 Annual Review of Chemical and Biomolecular Engineering,仅做学术分享使用;感谢每一位作者的辛苦付出与创作,除转载众多无法溯源的文章,我们均在文章中备注了来源。如转载涉及版权等问题,请联系我们删除,非常感谢!

 联系我们
联系我们





