免疫系统为入侵的病原体提供了关键的防御,面对对小分子药物的耐药性上升和新抗菌剂管道的萎缩,这些病原体变得越来越重要。保护性抗体是任何免疫反应的关键组成部分,因为它们可以中和分泌的毒素,阻断与宿主细胞的相互作用,并招募免疫系统防御。这些抗体可以通过自然感染或疫苗接种引起,也可以作为纯化的蛋白质被动给药。
目前单克隆抗体药物已用于五种传染病:呼吸道合胞病毒(RSV)、炭疽、复发性艰难梭菌、SARS-CoV-2和埃博拉病毒。事实证明,开发针对更复杂的病原体的有效疫苗和抗体药物具有挑战性,因为自然免疫力通常不足以防止再感染。这些病原体编码多种蛋白质,其表达由复杂的调控途径协调,在不同的疾病状态下表达的抗原很少。功能冗余毒力因子和菌株变异的表达会使靶标选择进一步复杂化。此外,许多病原体已经进化出多种免疫逃避策略,在某些情况下,可以在吞噬作用后避免消除。即使是基因相对较少的病原体,如流感和SARS-CoV-2病毒,也设法迅速逃避针对少数靶向蛋白质的免疫反应,这强调了对更复杂的抗体的需求。因此,在上篇介绍针对病原体保护脆弱的抗原表位进行重组抗体的设计和开发策略之后,我们今天总结下靶向破坏抗体Fc功能的病原体进行重组抗体的设计和开发策略。
尽管有许多努力集中在开发中和或封闭抗体,但Fc效应功能在保护作用中的作用越来越得到认识。这些可由人IgG1和IgG3同种型介导,后者与宿主Fc受体结合,通过自然杀伤(NK)细胞、中性粒细胞和巨噬细胞的抗体依赖性细胞吞噬作用以及补体依赖性细胞毒性介导ADCC。这些反应依赖于Fc与补体成分C1q和经典激活性Fc受体CD16A和CD32A的相互作用,而这两种受体高度依赖于靶细胞表面的抗原密度和表位可及性。虽然Fc相互作用可导致抗体依赖的增强型疾病,尤其是在登革热感染中,但它们通常代表了适应性免疫应答的强大力量,可以补充中和抗体。不幸的是,这也为病原体提供了选择压力,使其通过降解或隔离抗体来逃避这些功能。针对抗裂解、阻断蛋白酶活性或抗抗体隔离而设计的抗体为消除这些免疫逃逸策略提供了机会。
抗致病性蛋白酶活性的抗体
木瓜蛋白酶和胃蛋白酶等酶通常通过分别在上铰链区和下铰链区切割序列来产生Fab和F(ab ')2抗体片段。几种与肿瘤侵袭和炎症相关的人基质金属蛋白酶(MMPs),如MMP-3和MMP-7,也可以切割免疫球蛋白,这表明这些特征在系统发育过程中是常见的。作为免疫逃逸的一部分,细菌可以分泌具有同源功能的酶。例如,链球菌热原性外毒素B (SpeB)、免疫球蛋白g降解酶(IdeS)和内糖苷酶(enos)是由化脓性链球菌和裂解抗体分泌。SpeB对免疫球蛋白有广泛的特异性,ide对IgG铰链有特异性,而EndoS会去除与Fc受体结合所需的N297残基上的糖。类似地,金黄色葡萄球菌产生谷氨酰内肽酶V8 (GluV8),该酶在上铰链区切割免疫球蛋白,而铜绿假单胞菌分泌大量的弹性蛋白酶B (LasB),该酶也可能在铰链区切割免疫球蛋白。
虽然生物技术的应用是有效的,但抗体裂解可能不利于保护性免疫反应。事实上,添加蛋白酶抑制剂降低了抗体切割,同时增加了C3b补体沉积和中性粒细胞对金黄色葡萄球菌的吞噬。大多数IGg特异性蛋白酶采用两步过程:一个重链铰链被裂解,产生一个中间产物,然后第二个铰链被缓慢裂解,产生Fc和Fab或F(ab ')2片段。单独切割的IgG保留抗原结合活性,但不再促进效应功能。在许多个体中观察到与裂解的IgG1结合的自身抗体,这表明这一中间产物具有免疫原性和生理学意义。裂解抗体在细菌表面的累积会抑制完整抗体与抗原的接触,从而减少Fc效应功能的募集。因此,即使是不完全的抗体裂解也能有效地逃避免疫反应。
为了恢复因抗原结合抗体和裂解抗体而丧失的Fc效应细胞功能,研究者探索了使用可识别裂解产生的新表位的抗体(Figure 2)。这些完整的抗体可以重建靶细胞和吞噬细胞上Fc受体之间中断的联系。Jordan等通过在兔感染模型中使用与GluV8快速裂解的金黄色葡萄球菌表面结合的抗体来评估这种方法。作者表明,使用类似于抗体铰链序列的肽进行免疫可引起特异性识别gluv8裂解抗体的强抗体反应。与未免疫组相比,用铰链样肽免疫的兔的金黄色葡萄球菌定植水平降低,并且在体外试验中,这些动物的血清恢复了补体依赖性细胞毒性。
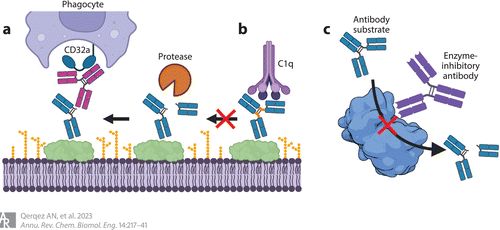
Figure 2 Antibodies that resist pathogenic protease activities to sustain recognition by host immune proteins, such as the C1q component of complement and CD32a Fc receptor found on phagocytes. (a) Antibodies recognizing hinge epitopes exposed after cleavage restore Fc functions to cleaved antibodies. (b) Antibodies with engineered hinge regions no longer serve as suitable substrates for pathogenic proteases. (c) Antibodies that block the activity of pathogenic proteases by directly blocking access to the active site (shown) or noncompetitive allosteric mechanisms (not shown) can protect antibody functions. Shown is the structure of LasB (PDB 3DBK). Adapted from images created with BioRender.
构建抗裂解抗体是对抗蛋白水解降解的另一种策略。虽然IgG1是人体内含量最多的同种型,也是药物性抗体最常见的同种型,但IgG2通常对蛋白水解性裂解更有抗性。然而,与IgG1相比,IgG2与CD16a和C1q的结合更弱,并相应地介导减少Fc依赖性杀伤和补体沉积。将IgG2的弹性与IgG1的功能相结合的努力导致了嵌合体,其中IgG2的下铰链和CH2序列取代了IgG1的。然而,抗体也通过在保守的下端铰链与经典Fc受体结合,这一区域是许多蛋白酶的底物。因此,增加抗体抗裂解能力的突变也对Fc受体结合和免疫效应功能的募集产生负面影响。
为了解决对抗体蛋白酶抗性的需求,同时保留效应物的功能,我们产生了IgG1/IgG2混合抗体。Kinder等首先通过引入E233P/L234V/L235A替换和删除Gly236,将IgG2的下铰链引入到IgG1中。正如预期的那样,在体外试验中,这种结构失去了促进补体杀伤和吞噬的能力。之前确定的选择性激活补体杀伤或调理吞噬作用的突变随后被引入该嵌合体。变异体2h-DE (S239D/I332E)恢复了Fc受体结合,而变异体2h-AA (K326A/E333A)恢复了补体杀伤。结合这些突变产生2h-DAA (239D/K326A/E333A)和2h-AEA (K326A/I332E/E333A)恢复了补体杀伤和调理吞噬活性,同时保持了对多种蛋白酶(化脓性链球菌IdeS、金黄色葡萄球菌GluV8、MMP-3和MMP-12)切割的抗性(图2b)。蛋白酶耐药Fc结构域的加入可能支持药物性抗体的开发,以用于细菌感染(细菌感染的库中包括抗体降解蛋白酶)。
用中和抗体直接靶向蛋白酶是阻断蛋白水解活性的一种替代方法,具有阻断所有底物裂解的优点。这种方法最初用于肿瘤相关的MMPs,从而鉴定出Kivalues ~ 5 nM(78)作为竞争性抑制剂的抗体。它扩展到铜绿假单胞菌假溶素(LasB)蛋白酶,该酶通过切割弹性蛋白、胶原、IgA、IgG和补体蛋白来支持早期感染
抗蛋白水解裂解的抗体可能提高其保护能力,并且可以通过识别抗降解的Fc取代来实现。重组抗体工程的一个吸引人的特点是,一旦开发出合适的工程Fc,它可以与结合任何抗原的Fab臂结合。或者,可以为每一种感兴趣的蛋白酶开发酶抑制抗体。如果得到单克隆抗体研究的支持,经过适当工程改造的蛋白酶免疫原可增强天然抗体和疫苗诱导的多克隆抗体产生的保护作用。
阻断细菌fc结合蛋白质类的抗体
各种细菌病原体表达与保守抗体序列结合的毒力因子。这些捕获的抗体可以屏蔽病原体,阻断免疫对其他表面抗原的接触,拮抗Fc效应功能,甚至改变免疫细胞信号传导。虽然多种生物分泌抗体结合蛋白,包括金黄色葡萄球菌第二免疫球蛋白结合蛋白(Sbi)、化脓性葡萄球菌蛋白G和M以及大胃链球菌蛋白L,但研究最多的是金黄色葡萄球菌蛋白A。蛋白A在所有定植株中均有表达,由5个同源结构域组成,每个同源结构域均能与除IgG3以外的所有人类IgG同型和除IgG1以外的所有小鼠IgG同型的Fc高亲和力结合(KD值为2.6-14 nM)。
当蛋白A通过c端锚定附着于细菌细胞壁时,可阻断抗葡萄球菌抗体对表面抗原的接触。它还通过干扰IgG六聚体形成和通过空间阻断Fc与低亲和力Fc受体的相互作用(Figure 5)来防止抗体依赖性补体激活。
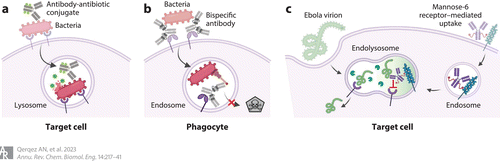
Figure 5 Antibodies that target intracellular pathogens. (a) Antibody–antibiotic conjugates bind bacterial surface antigens and are internalized with the bacteria by natural or phagocytic mechanisms. Once internalized, the antibiotic is released by resident enzymes to kill co-localized bacteria. (b) Bispecific antibody MEDI3902 uses one binding site to bind the Psl surface antigen on Pseudomonas aeruginosa and mediate phagocytosis. After translocation to the endosome, the second antibody-binding site blocks type III secretion to support endosome acidification and bacterial killing. (c) The mannose-6-phosphate receptor can mediate antibody transfer to an endolysosome that may already contain Ebola virions. Once co-localized, the antibody can block Ebola–receptor interactions to prevent viral escape into the cellular cytosol. Adapted from images created with BioRender.
此外,一些蛋白A从细菌表面释放,可与vh3型b细胞受体或抗体Fc结构域结合。B细胞受体交联激活B细胞,导致克隆扩增和凋亡塌陷,从而限制抗葡萄球菌应答(Figure 3b)。与游离抗体的Fc结构域结合可以在细胞循环过程中阻断与新生儿Fc受体(FcRn)的相互作用,从而靶向抗体进行溶酶体降解(Figure 3c)。
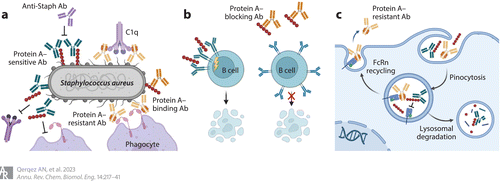
Figure 3 Antibodies that resist capture by Fc-binding protein A. Staphylococcus aureus protein A disrupts antibody responses in multiple ways but can be restored by Fc domains with reduced protein A affinity (most IgG3 allotypes or engineered IgG1 domains) or antibodies that bind protein A to block Fc capture. (a) Membrane-bound protein A can block antibody Fc binding to the low-affinity Fc receptors CD16b and CD32a, block the Fc hexamerization required for efficient recruitment of C1q to activate complement, and shield the bacterial surface from recognition by antibody Fab domains. Secreted protein A can (b) crosslink VH3 domains to trigger B cell receptor activation and apoptotic collapse and (c) block antibody recycling by Fc/FcRn binding to reduce antibody half-life. Unmodified antibodies are shown in green, Fc engineered antibodies are shown in yellow, and antiprotein A antibodies are shown in orange. Abbreviations: Ab, antibody; FcRn, neonatal Fc receptor. Adapted from images created with BioRender.
已经探索了用单克隆抗体的抗原结合抗原表位直接靶向蛋白A,以阻断其Fc结合活性,支持细菌的调理吞噬作用。抗体514G3与在有血清抗体的情况下细菌表面可接近的蛋白a表位结合。在小鼠模型中,在耐甲氧西林金黄色葡萄球菌致死性攻击前给药时,该抗体显示出保护作用,而较低的抗体剂量与万古霉素抗生素治疗显示出协同作用。
抗体3F6与蛋白A和相关蛋白Sbi结合,阻断Fc捕获和B细胞交联效应(Figure3b)。用3F6作为小鼠IgG2a进行被动免疫可保护新生小鼠免受血流感染,并使其血清中针对其他金黄色葡萄球菌抗原的IgG滴度较高。
人们一直在努力设计能引起强512G3和3f6样蛋白A应答的抗原,目的是降低蛋白A对Fc的亲和力。与野生型蛋白A不同,一个名为SpAKKAA的初始解毒变异体,SpAKKAA免疫可诱导产生高滴度抗体,从而促进调理吞噬细胞杀伤,并保护小鼠免受金黄色葡萄球菌血流感染。然而,SpAKKAA持续引起动物应激,提示其保留了部分B细胞超抗原活性。SpAKKAA等免疫原能更好地诱导抗体干扰蛋白A的功能,因为即使在Fc存在的情况下,关键表位仍然暴露。这种方法为设计其他Fc结合蛋白的免疫原提供了希望。
抗Fc结合蛋白捕获的抗体
为了支持开发用于疾病的单克隆抗体,可以对抗体Fc结构域进行改造,以降低对致病性Fc结合蛋白的亲和力。先前的研究表明,由于聚焦化或氨基酸序列的改变,抗体对活化的CD16a和CD32a宿主受体具有更高的亲和力,从而增强了与癌症相关的效应功能。然而,这些和相关的Fc变化对感染性疾病反应的潜在影响还不太清楚。
为了确定抗蛋白A捕获的抗体是否介导了更强的金黄色葡萄球菌吞噬作用,我们选择了一种与丰富的表面糖共聚物壁磷壁酸结合的抗体。两个降低蛋白A结合亲和力的残基改变(H435R和Y436F)被引入人IgG1 Fc结构域。类似Fc结合蛋白由疱疹病毒表达,当这些病毒Fc受体在感染细胞表面表达时,它们可以捕获与邻近病毒糖蛋白结合的抗体Fc结构域。
这种拮抗作用可抑制Fc与免疫细胞上的宿主Fc受体的结合和信号传导,并可导致抗体内化,用于溶酶体降解或重新包装,使抗体覆盖病毒粒子。同样,当使用缺乏病毒Fc受体的病毒株感染成纤维细胞时,结合巨细胞病毒蛋白的抗体结合人Fc受体,并更有效地诱导ADCC。这表明,Fc结构域可以被设计来增强非中和性抗疱疹病毒应答(如ADCC)的效力。
防止病原体隔离抗体可以使宿主免疫系统有效地应对感染。在金黄色葡萄球菌中,抗体514G3阻断了蛋白A与任何抗体Fc的结合,而使用IgG3 Fc可防止蛋白A破坏治疗性抗体活性。这些报告为靶向蛋白A的抗体提供了概念验证,可能扩展到其他Fc结合蛋白。结合重组抗体技术的进步,我们认为利用抗体逃逸途径的知识开发设计Fc结构域可介导针对特定病原体的有效效应功能。

 联系我们
联系我们





