人口密度、旅行频率和免疫受损个体数量的增长增加了病原体致病的机会。重组抗体技术可以帮助确定病原体的免疫逃逸机制,并通过识别功能相关的抗体靶点、改造抗体使抗体逃逸策略无效以及捕获隐藏在宿主细胞内的病原体来对抗病原体的免疫逃逸机制。
结合保守和可及靶点的抗体通常需要宿主免疫应答来预防或化解感染。在这些情况下,调理过的病原体可通过多种机制被破坏,包括补体溶解、吞噬作用或NK介导的对受感染细胞的杀伤。例如,简单地用抗体标记病原体,通过Fc受体而不是自然入侵途径介导吞噬作用,就可以将病原体送到溶酶体进行破坏。作为应答,细菌和病毒病原体进化出了逃避这些保护性免疫功能的策略,包括破坏补体级联或削弱宿主免疫细胞捕获和破坏内化病原体能力的蛋白质。阻断免疫逃逸蛋白的抗体可以恢复免疫功能,而工程抗体可以靶向隐蔽的细胞壁龛中的细菌。
保护补体活性的抗体
经典补体途径被大量表面抗原激活,这些表面抗原使IgG抗体能够结合和六聚化,或者更有效地与天然五聚体或六聚体IgM分子结合(Figure 4)。这些抗体随后可与C1q蛋白的6个球状头结合,从而激活蛋白水解级联。由此导致的C3b沉积在病原体表面,通过与白细胞上的补体受体(尤其是补体受体3)结合介导吞噬作用。如果C3b密度高,则可形成裂解膜攻击复合物来裂解革兰阴性菌和病毒粒子。因为不是所有的抗原都在空间上排列以支持IgG六聚体的有效形成,残基的变化(E430G和E345K或-R)被确定为独立增加Fc-Fc相互作用支持六聚体的形成,导致C1q结合增加和5 - 7倍的补体激活。当与靶向保守淋病奈瑟菌脂寡糖表位的抗体结合时,与未修饰的Fc相比,这些经过改造的HexaBody Fc结构域通过仅需要补体激活的机制介导了小鼠体内细菌清除的增强。
补体逃避策略在细菌病原体中常见,包括产生胶囊以保护抗体接触到抗原、招募补体抑制剂的表面抗原和切割补体蛋白的蛋白酶(Figure 4)。靶向这些抗原的抗体可同时阻断抑制剂与抑制剂的结合,并将C1q招募到病原体表面,从而起到杀灭细菌的作用。与奈瑟氏菌结合的抗体最有力地证明了这一点,奈瑟氏菌是细菌性脑膜炎和脓毒症的一个重要原因,经典补体途径在杀菌作用中占主导地位。
然而,fHBP被推测在血清中与fH形成复合物,这将限制保护性抗体的产生,而保护性抗体可竞争性抑制fH/fHBP的相互作用。为了解决这一问题,研究人员利用重组技术开发了fH免疫原,改良后的fHBP免疫恒河猴后,血清IgG滴度比原fHBP提高3倍,血清杀菌滴度比原fHBP提高150倍,这与补体成分C4b在活菌上沉积增加有关。这些数据提示,靶向其他生物体表达的逃避补体的抗原可能支持疫苗研发工作。
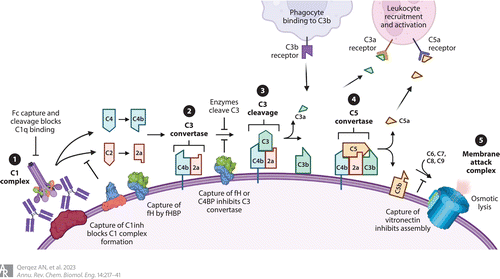
Figure 4 Microbial disruption of the classical complement cascade by recruiting inhibitors or degrading complement proteins. Key steps of the classical pathway of antibody activation are shown: ① The complement proteins C1q and then C1r and C1s bind hexamerized IgG or IgM on the pathogen surface to form the C1 complex. ② Complement components C2 and C4 are cleaved to produce membrane-bound C4b and C2a, which form the C3 convertase. ③ This cleaves C3 to release C3a and deposit C3b covalently on the membrane. ④ When C3b levels are high, it joins the C3 convertase to form the C5 convertase, which cleaves C5 to release C5a and deposit C5b on the membrane. ⑤ Components C6–C9 join C5b to form the membrane attack complex and osmotically lyse the target membrane. Released C3a and C5a are chemoattractants for leukocytes, while membrane-bound C3b can engage complement receptors such as CR3 to trigger phagocytosis. The lectin pathway follows a similar cascade but is initiated by the mannose-binding lectin complex, which recruits C1q; the alternate pathway results from spontaneous C3 cleavage and C3b deposition to enter at the C3 convertase step using an alternate C3b/Bb complex. Many of these steps can be inhibited by pathogen components, including proteins that bind or cleave Fc to inhibit C1q recruitment (e.g., protein A and staphylokinase), proteins that recruit host complement regulators (e.g., the Neisseria fHBP, which recruits fH, and Bordetella pertussis Vag8, which recruits C1 inhibitor), and enzymes that degrade complement components (e.g., staphylokinase depletes C3). Engineering efforts to overcome these strategies include the use of HexaBodies, which favor C1q binding; antibodies resistant to capture by Fc-binding proteins or cleavage by bacterial proteases; and antibodies that block recruitment of complement inhibitors such as factor H. Abbreviations: fH, factor H; fHBP, factor H binding protein. Adapted from images created with BioRender.
保护白细胞功能的抗体
许多细菌产生白细胞毒素,而白细胞毒素会损害免疫细胞捕获和摧毁病原体的能力。金黄色葡萄球菌产生一系列具有冗余互补功能的杀白细胞素,包括α-溶血素(Hla)和5种双组分细胞毒素HlgAB、HlgCB、LukSF、LukED和LukGH。
一旦调理抗体结合病原体表面的保守表位,白细胞毒素的分泌可能会限制吞噬之前或之后的细菌杀灭。在这种情况下,阻断白细胞毒素活性的抗体有望与调理抗体产生协同作用。Tkaczyk等表明,在金黄色葡萄球菌感染的致死性肺炎和菌血症模型中,与调理抗体结合的ClfA与中和抗体的Hla有协同作用。
靶向内化细菌的抗体-抗生素偶联物
虽然传统上认为胞内细菌具有专性或兼性胞内生活方式,但越来越多的人认识到,被吞噬的细菌可以作为活生物体的储存库,以种子感染。例如,金黄色葡萄球菌很容易被巨噬细胞和中性粒细胞吞噬。虽然大多数内化的细菌被杀死,但有一部分抵抗杀死,并利用吞噬细胞介导扩散到其他部位。对于金黄色葡萄球菌来说,细胞内存活帮助细菌逃避固有免疫防御,并通过程序性坏死破坏中性粒细胞,杀白细胞素通过诱导程序性坏死介导细菌生存/逃逸。此外,许多病毒在低PH核内体中进行进入宿主细胞所需的膜融合事件(例如流感和埃博拉病毒)。在这两种情况下,免疫系统、抗体和抗生素基本上无法接触到细胞内的病原体。巧妙的工程策略可以向这些细胞内生物递送多功能抗体,从而支持通过天然免疫细胞功能或联合递送抗生素来破坏病原体。
调理抗体已被设计用于将抗生素或其他抗毒分子与细胞内病原体共定位。多功能抗体-抗生素偶联物依赖于与丰富的细菌表面抗原结合的抗体成分,将其标记为吞噬入核内体,核内体可能含有之前内化的细菌(Figure 5a)。在体外,抗体-抗生素偶联物杀死了巨噬细胞、内皮细胞和上皮细胞内化的细菌。
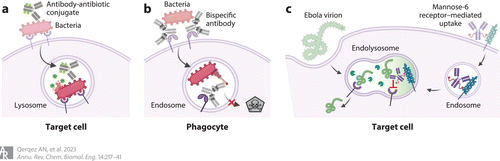
Figure 5 Antibodies that target intracellular pathogens. (a) Antibody–antibiotic conjugates bind bacterial surface antigens and are internalized with the bacteria by natural or phagocytic mechanisms. Once internalized, the antibiotic is released by resident enzymes to kill co-localized bacteria. (b) Bispecific antibody MEDI3902 uses one binding site to bind the Psl surface antigen on Pseudomonas aeruginosa and mediate phagocytosis. After translocation to the endosome, the second antibody-binding site blocks type III secretion to support endosome acidification and bacterial killing. (c) The mannose-6-phosphate receptor can mediate antibody transfer to an endolysosome that may already contain Ebola virions. Once co-localized, the antibody can block Ebola–receptor interactions to prevent viral escape into the cellular cytosol. Adapted from images created with BioRender.
这一策略耗尽了不易接近的细菌储存库,否则这些储存库将成为反复感染的来源。虽然杀菌活性是新型抗生素的关键要求,但这些分子通常也具有不良的宿主毒性。与抗体结合的益处是降低治疗剂量,同时延长循环半衰期,并在释放前将抗生素定位到感染部位。
这种策略可以减少全身毒性,同时在吞噬体内达到杀灭细菌所需的高局部抗生素浓度。它可能也适用于专性病原体,例如伯克霍尔德菌属。
用于获取内化病原体的双特异性抗体
双特异性抗体使用类似的方法,其中一个结合位点标记病原体,使其被吞噬,而另一个发挥互补功能,如阻断使细胞内位点适合病原体的毒力因子。这类药物中最先进的方法是MEDI3902,该药物最近完成了Ⅱ期临床试验(NCT02696902)。双特异性抗体的产生是通过一组阻断核内体pH的受体结合位点,而另一组通过结合病毒粒子上保守的非中和表位来介导吞噬和核内体递送。这一概念可以扩展到阻断其他蛋白质的功能,这些蛋白质支持病原体逃逸或维持内体作为病原体的适宜环境,例如金黄色葡萄球菌白细胞毒素。
上述策略需要抗体和病原体在内化之前相互作用,这可能为治疗已确立的感染或清除所有细胞内病原体带来挑战。作为替代方案,抗体可以单独递送,与已经存在于核内体或溶酶体中的病原体结合。这可以通过胞饮作用和FcRn介导的抗体跨上皮细胞转运发生;在这一过程中,含有抗体的内体可以与含有流感病毒颗粒的内体融合,从而中和血凝素,防止流感病毒与宿主细胞膜融合。
这里描述了三种互补的策略来靶向隐藏在细胞内的病原体。抗体可阻断阻止宿主细胞杀死内化细菌的细胞毒素活性,或者可介导将抗生素和细菌靶向递送至吞噬体,从而杀灭细胞内细菌。在这两种情况下,确定细菌表面抗原作为抗体靶点,并在吞噬之前将抗体与病原体结合对于成功进行吞噬至关重要。较新的方法将保护性抗体靶向递送到已经含有病原体的细胞内区室,可能对于已发生的感染有优势。
任何新的策略都可能施加选择压力,促使性状发生改变的生物体出现。然而,许多病原体的持续存在以及新病原体的出现强调了预防和改善感染的创新方法的必要性。

 联系我们
联系我们





