RSV感染导致广泛的人肺上皮损伤,这是一种促炎的固有免疫应答,并引发了一种自然的适应性人体免疫应答,从而产生保护性免疫。一项发表于《JCI Insight》的研究证明了人类T细胞在控制RSV感染中的关键作用。具体而言,在没有RSV特异性抗体应答的情况下,经活化的人CD8+ T细胞或CD4+ T细胞可有效且独立地控制人肺组织中的RSV复制。
呼吸道合胞病毒(Respiratory syncytial virus, RSV)是一种负性单链RNA病毒,是婴幼儿急性下呼吸道感染的最常见原因。在全球范围内,RSV感染每年与10万多例婴幼儿死亡相关。RSV也是老年人发病和死亡的一个重要原因,在美国65岁及以上的成人中,约有200,000例住院和14,000例死亡可归因于RSV感染。RSV是免疫抑制人群(包括移植受者)的重要威胁。
目前被批准用于RSV感染的药物包括单克隆抗体帕利珠单抗(Palivizumab, Synagis)和抗病毒核苷类似物利巴韦林,以及被欧盟批准用于预防婴儿RSV的单剂长效单克隆抗体Niresivamib。
此前已有研究表明,将人肺组织植入免疫缺陷小鼠(仅肺小鼠[LoM])后,人肺组织随着时间的推移继续发育,人上皮细胞、平滑肌细胞、成纤维细胞和内皮细胞形成了具有广泛血管化的人肺结构。证明了人肺植入物可以在不需要物种适应的情况下研究人呼吸道病毒感染。当使用自体hla匹配的人类固有和适应性免疫细胞(产生骨髓/肝/胸腺-肺[BLT-L]小鼠)重建LoM时,人类肺部感染可引发病原体特异性人类抗体和T细胞应答,这些抗体和T细胞应答可控制病毒复制(例如人巨细胞病毒[HCMV])。研究人员利用这些互补的体内模型(LoM和BLT-L小鼠)评估人体免疫相关因素对RSV感染的保护作用,重点是人T细胞在介导肺组织中病毒清除中的作用。
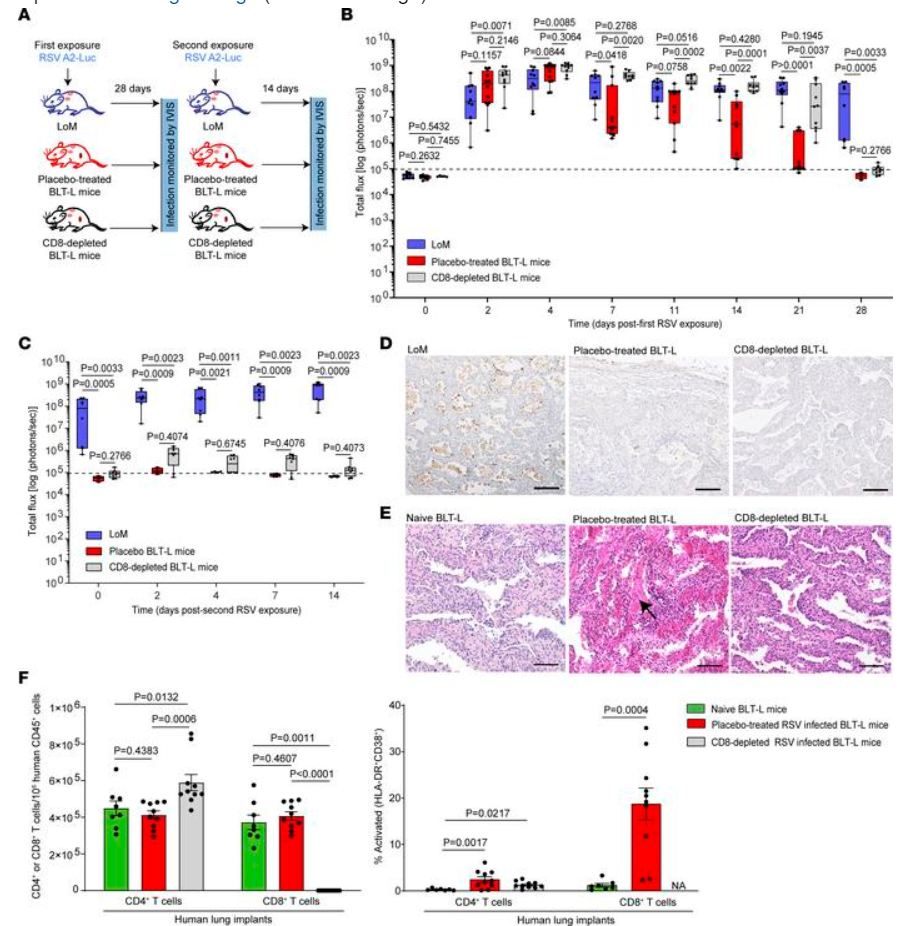
在缺乏自体人类免疫系统(LoM)的情况下,RSV感染会随着时间的推移持续存在,且不会被清除。相反,在BLT-L小鼠中,RSV感染诱导了一种病毒特异性的人类抗体(IgM和IgG)和T细胞应答,能够在第二次RSV攻击后预防感染。重要的是,研究证明,在没有RSV特异性抗体应答的情况下,经激发的人CD8+ T细胞(以及在较小程度上的人CD4+ T细胞)可有效且独立地控制人肺组织中的RSV感染。总之,这些临床前数据支持了一条重要的前进道路,并为开发和测试可诱导保护性T细胞应答的RSV疫苗提供了体内模型。

 联系我们
联系我们





