与传统抗体(Abs)的VH结构域相比,纳米抗体(Nbs)具有很高的结构相似性。更具体地说,如图所示,纳米抗体(Nbs)由位于Nb尖端的3个高度可变的环(互补决定区,CDR1/2/3)和4个保守序列区(框架区,FR1/2/3/4)组成。这3个CDR环形成Nb的抗原结合位点,称为paratope,其中CDR3贡献了大部分抗原结合特异性,而CDR1和CDR2负责增强结合强度。
纳米抗体(Nbs)的一个显著特征是CDR3环比传统抗体更长,如图所示。大多数纳米抗体(Nbs)的指状CDR3结构包含约18个氨基酸,而抗体(Abs)的CDR3环仅包含12或14个氨基酸。与传统抗体的CDR3环相比,扩大的CDR3区域有可能在Nb和同源抗原之间提供更多的相互作用,从而部分平衡缺失的VL结构域突出CDR3上使纳米抗体(Nbs)非常适合识别传统抗体无法识别的独特表位并与之相互作用。手指状的CDR3和延长的形状共同扩大了Nbs的潜在靶标。

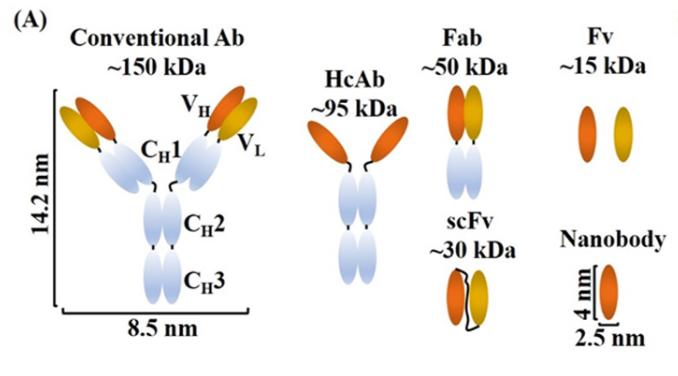
纳米抗体(Nbs)的另一个值得注意的特点是与传统抗体(Abs)相比,纳米抗体(Nbs)的体积显著缩小。这种小尺寸使纳米抗体(Nbs)能够从静脉快速外渗,快速扩散到全身,并深入到肿瘤组织中,使其适合于分子成像和实体瘤治疗。虽然纳米抗体(Nbs)小通常被认为是一个优势,特别是在无创成像中,但公平地说,它也可能是一个局限性。
由于纳米抗体(Nbs)的分子量低于肾小球滤过的阈值(50 ~ 60 kDa),一个潜在的问题是肾脏从血流中快速清除纳米抗体(Nbs)。因此,只有一小部分注射的纳米抗体(Nbs)在病变部位累积。频繁给药对于获得最佳疗效至关重要。为了解决这一局限性,人们做出了大量努力来延长纳米抗体(Nbs)的半衰期。已有研究表明,白蛋白可作为延长药物半衰期的通用平台,基于白蛋白的策略也被应用于纳米抗体(Nbs)技术。2011年发表了一项研究,该研究开发了一种双特异性三价纳米抗体(Nbs),包括一种靶向EGFR的二价纳米抗体(Nb)和一种靶向白蛋白的纳米抗体(Nb)组成 。白蛋白参与三价Nb,导致小鼠的半衰期延长了2-3天。
纳米抗体(Nbs)的另一个特点是其极其稳健。结果表明,传统抗体FR2区域的4个疏水氨基酸被纳米抗体(Nbs)中的4个亲水氨基酸取代。在传统的抗体中,这些位于VH结构域表面的疏水氨基酸被认为是VL结构域的结合表面。纳米抗体(Nbs)中疏水氨基酸被亲水氨基酸取代被认为是纳米抗体(Nbs)溶解度和稳定性提高的主要原因。由于纳米抗体(Nbs)具有亲水性、缺乏翻译后修饰、较少的二硫键和单体结构,因此可以使用大肠杆菌表达系统(e.c oli)和酵母表达系统(S. cerevisiae)等低成本生产系统高产出纳米抗体(Nbs)。与之形成鲜明对比的是,单链抗体(scFV)由于其稳定性和溶解度下降,产量往往较低。
根据已发表的序列信息,VHH与人类3型VH结构域具有高度的序列同源性高序列一致性是纳米抗体(Nbs)低免疫原性的主要原因。研究纳米抗体(Nbs)靶向表达溶菌酶的转基因肿瘤能力的一项研究也支持这一观点。Ablynx进行的Ⅰ期临床试验也证明了纳米抗体(Nbs)固有的低免疫原性。纳米抗体(Nbs)的低免疫原性使其适合长期和重复给药。此外,纳米抗体(Nbs)人源化策略已经开发出来,目前在临床试验之前已成为常规策略,进一步减轻了不必要的免疫应答。然而,应该注意的是,在抗体人源化之后,额外的工程可能是必要的,以恢复纳米抗体(Nbs)对其目标的足够的作用能力。

 联系我们
联系我们





