自1997—1998年美国FDA批准6个治疗性单克隆抗体(单抗)上市以来,单抗在药物研发领域已占据了重要地位。虽然越来越多的单抗治疗药物获批进入临床应用,但抗体疗法的局限性也不容忽视。例如,使用阻断信号传导途径和诱导细胞凋亡的单抗的患者大多会复发,通过抗体依赖细胞介导的细胞毒性和补体依赖的细胞毒性的治疗效果因抗体而异。为克服单抗疗法的缺点,提高治疗效果,双特异性抗体(bi-specific antibody,BsAb)横空出世,并在包括癌症、炎症、神经退行性疾病、病毒感染及自身免疫病等等诸多另类成为研究热点。
双特异性抗体(BsAb)可以同时特异性结合2种不同抗原,已成为抗体工程领域研究的热点。据Patsnap新药情报数据库统计,目前全球有800多款双抗在研药物,中国也有400多款在研药物。从全球来看,进入临床阶段的双特异性抗体(BsAb)药物280多款,其中3款处于上市状态,12款处于III期临床。从国内的研发进展来看,进入临床阶段的双特异性抗体药物接近150款,其中3款申请上市,10款处于III期临床。历年来,全球已上市的4个双特异性抗体(BsAb)上市药物包括靶向EGFR & c-MET的埃万妥单抗(2021,Rybrevant);靶向FIX & FX的艾美赛珠单抗(2017,Hemlibra);靶向CD3 & CD19的倍林妥莫单抗(2014,Blincyto,安进);靶向CD3 & EpCAM的卡妥索单抗(2009,Removab,2017退市)。
双特异性抗体(BsAb)是指通过化学偶联、细胞工程(双杂交瘤细胞)和基因工程方法制备的,能同时结合2个相关抗原并产生生物学效应的一种抗体。由于化学偶联和双杂交瘤制备的双特异性抗体(BsAb)有一定的技术壁垒且性价比相对较低,近年来已逐渐被基因工程双特异性抗体(BsAb)所取代。
这些双特异性抗体(BsAb)研究主要集中在癌症治疗方面,虽疗效显著但还未达到临床最佳状态。由于双抗有2条重链和2条轻链,因而极易出现错配。随着双特异性抗体(BsAb)的研究发展,在结构设计上出现了许多不同的策略,如串联单链抗体(single chain fragment variable,scFv)、双可变结构域抗体或"knobs-into-holes"设计,还出现了一些多特异性抗体。纳米抗体作为目前已知最小的全功能抗体,具有优异的理化特性,为构建双-多特异性抗体提供了全新途径。
浙江大学药学院研究团队通过抗体工程改造,将两种靶向EGFR的纳米抗体串联,并与细胞毒素定点偶联,制备了一款多价、双识别表位的抗体偶联药物,实现了该生物药物的抗肿瘤活性增强以及解决了基因突变恶性肿瘤对传统单抗(如西妥昔单抗)的耐药问题,为恶性肿瘤的靶向治疗提供了生物技术药物方向的解决方案。
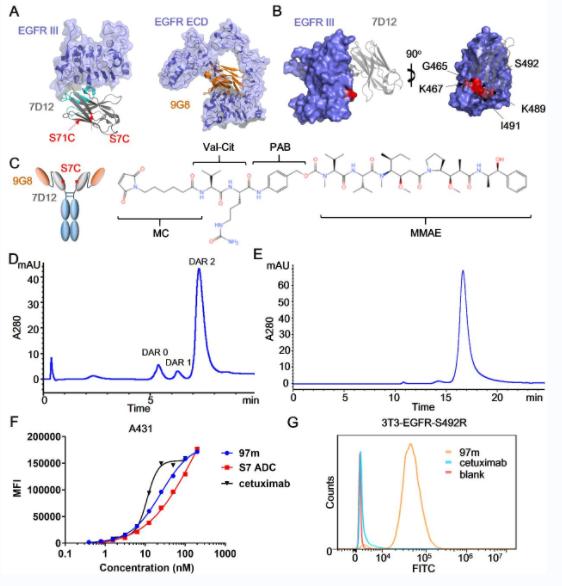
抗EGFR 纳米抗体-药物偶联物的设计
这种形式的抗体相比传统抗EGFR抗体可以更有效激活补体依赖的细胞毒性(complement dependent cytotoxicity,CDC)的同时,还尝试对抗体的Fc段进行改造以进一步增强其CDC效应,从而形成一种CDC强化型ADC药物。
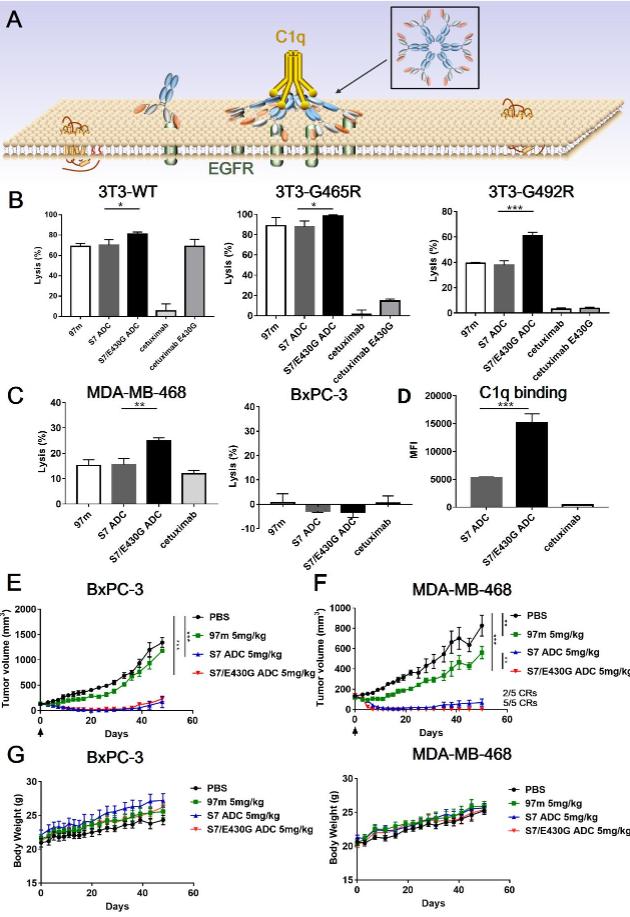
新型抗体偶联药物的体内抗肿瘤活性
这种新型的ADC形式,显著增强了抗体偶联药物作为“生物导弹”的靶向抗肿瘤活性,同时助力解决EGFR靶向治疗中常见的基因突变(胞外区)耐药,有望在成药后为恶性肿瘤患者提供更多用药选择。

 联系我们
联系我们





