纳米抗体(nanobody, Nb)在中枢神经系统疾病、循环系统疾病、感染性疾病、肿瘤学和炎症性疾病中均表现出优异的应用价值和前景,主要聚焦于肿瘤治疗且已经取得了显著成效,纳米抗体-药物偶联、CAR-T、光动力疗法(PDT)、靶向放射性核素治疗等治疗方法的不断研发改进为患者带来了新的希望。
| 表 2 纳米抗体在治疗领域的应用 | ||
| Table 2 Therapeutic applications of nanobodies | ||
| Nanobodies | Targets | Disease examples |
| ALX-0171 | RSV F-protein | RSV lower respiratory tract infection |
| T6T16A12 | Tetanus neurotoxin (TeNT) | Tetanus |
| Vobarilizumab | IL-6R | Rheumatoid arthritis |
| M6495 | ADAMTS-5 | Osteoarthritis |
| BI 655088 | CX3CR1 | Chronic renal disease |
| LCAR-B38M | BCMA | Multiple myeloma |
| EGFR-targeted nanobody | EGFR | Squamous cell carcinoma of head and neck |
| PDL1-VHHs | PDL1 | Cancer therapy |
| Everestmab | GLP-1/GLP-1R | Diabetes mellitus type 2 (T2DM) |
靶向肿瘤的纳米抗体
Altintas等研发了一种核心由EGFR靶向纳米抗体(nanobody, Nb)与PEG (EGa1-PEG) 结合的纳米粒子(NANAP),NANAP中装载有多激酶抑制剂17864,在溶酶体吸收和消化后,激酶抑制剂在细胞内释放,抑制EGFR阳性的14C鳞状头颈癌细胞的生长。Fang等将药物美登素(DM1) 与MHC-Ⅱ靶向纳米抗体VHH7结合,通过NIR成像及向健康小鼠和荷瘤小鼠注射VHH7-AF47,解剖后比较荧光信号证实了淋巴瘤在肺、肝、脾、淋巴结等器官中的存在且肝脏中有转移灶,肿瘤浸润导致脾肿大,并证实了VHH7对转移灶的靶向性,用A20细胞系作为模型,VHH7-DM1治疗组肿瘤明显小于对照组,小鼠平均存活时间长于对照组,可显著抑制肝脏病灶转移。CD7分子黏附抗体或抗体衍生物后可快速发生内吞作用。Tang等以单价和双价抗-CD7纳米抗体为基础构建了免疫毒素,并将其编码为PG001和PG002,采用WST-8法测定细胞毒活性,两者分别在纳摩尔(PG001) 和皮摩尔(PG002) 浓度下能诱导T-ALL细胞系的高效抗原特异性凋亡,能有效、选择性地杀伤人白血病细胞,显著延长治疗后小鼠的存活时间。
放射性标记的纳米抗体(nanobody, Nb)也有望成为靶向放射性核素治疗的靶向药物。其中α粒放射性核素正在用于临床或临床前评估,2Rs15d是一个HER-2特异性纳米抗体(nanobody, Nb),Pruszynski等利用2Rs15d纳米抗体(nanobody, Nb)与偶联剂2-(4-异硫氰基苄基)-1, 4, 7, 10-四氮杂环十二烷-1, 4, 7, 10-四乙酸(p-SCN-Bn-DOTA),并用α发射性核素锕-225标记(α-225Ac),产生225Ac-DOTA-Nb,这种靶向纳米抗体(nanobody, Nb)可以为靶细胞提供高致死性和局部化的放射治疗。
纳米抗体(nanobody, Nb)可充当光敏剂(photosensitizer, PS) 的载体,用于靶向光动力疗法(photodynamic therapy, PDT),通常临床上使用疏水的光敏剂,不能提供肿瘤特异性。增加肿瘤细胞特异性受体的表达水平可以用于靶向这些细胞,即增加肿瘤对光敏剂的特异性摄取,如过度表达的EGFR等常被用作靶向治疗的靶点。采用纳米抗体(nanobody, Nb)的PDT可将周围细胞的损害降低,纳米抗体-PS共轭物选择性地结合到靶标上,并且在照明后能够在体外诱导选择性地杀死肿瘤细胞。
用于病毒感染的纳米抗体
纳米抗体(nanobody, Nb)还是中和抗病毒试剂的丰富来源,可作为治疗动、植物病毒感染的理想工具。SARS-冠状病毒-2 (SARS-CoV-2) 的出现导致了一种全球性的流行病,比以往的冠状病毒传播性更强,不同的纳米抗体(nanobody, Nb)已经被开发用于高亲和力结合受体结合域(RBD),竞争性地抑制RBD与人血管紧张素转换酶2 (ACE2) 的相互作用并中和病毒[65-67],纳米抗体(nanobody, Nb)主要依赖于3个可变环,即图CDR1、CDR2、CDR3形成的抗原结合位点,纳米抗体(nanobody, Nb)相关技术的成熟揭示其可作为高效的中和剂,抵御致病性冠状病毒的侵袭。
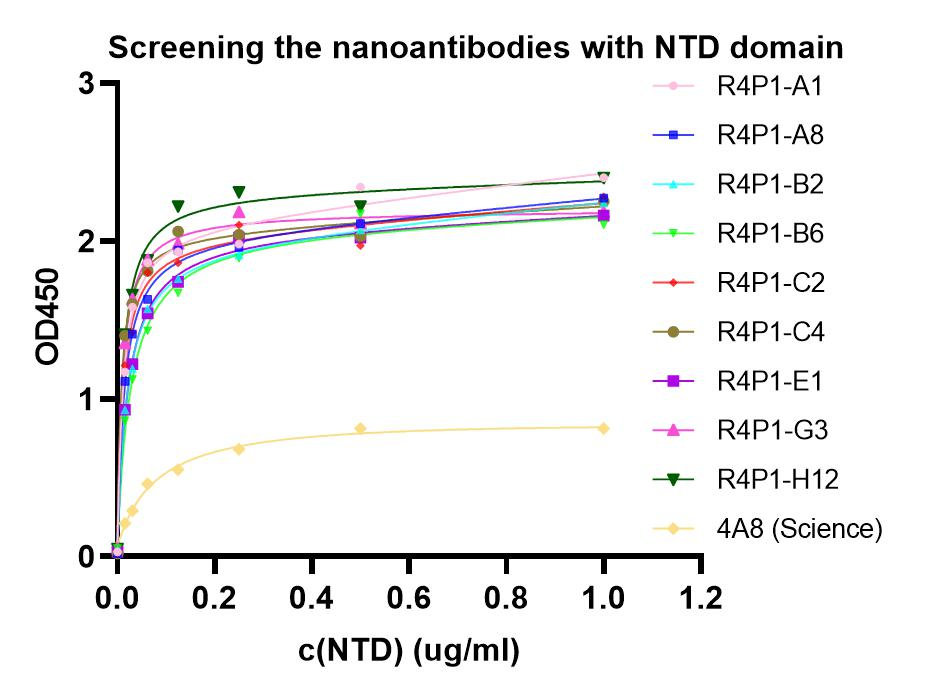
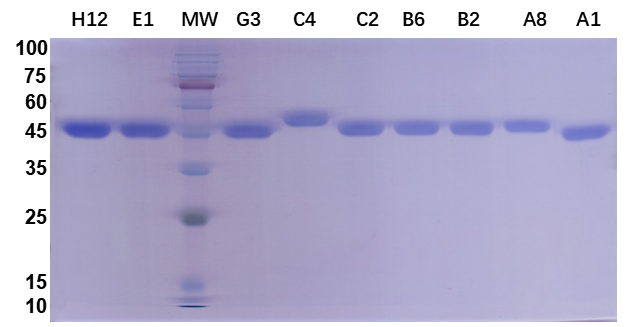
普健生物构建了千亿级纳米抗体VHH文库,淘选了针对新冠NTD domain的纳米抗体(nanobody, Nb),获得了9条VHH序列,并采用哺乳系统进行了9条VHH-Fc的重组表达,9条VHH-Fc序列的表达量均较高。

Strokappe等成功构建了靶向HIV gp41和gp120包膜蛋白的中和性纳米抗体,这些新的双特异性VHH有成为治疗剂或杀菌剂的潜力。BBMV是一种种子传播的植物病毒,Ghannam等通过噬菌体展示生物淘选分离出8个BBMV特异性纳米抗体,其中3个成功地抑制了BBMV在体外的传播且在蚕豆中表达时能中和BBMV。Orlov等分离出抑制葡萄扇叶病毒(grapevine fanleaf virus, GFLV) 的纳米抗体Nb23,在烟草和该病毒的天然宿主葡萄砧木中稳定表达并观察到了对GFLV强烈的特异性抵抗力。
用于抗菌素的纳米抗体
抗生素疗法是治疗细菌性感染的主要手段,但由于抗生素不合理、过度的使用,导致耐药菌甚至超级细菌的出现,对于严重感染的病例,抗生素已经无法发挥其抗菌抑菌的作用。
而纳米抗体(nanobody, Nb)由于特异性强,能精确结合致病细菌表面抗原,拮抗细菌对宿主细胞的黏附,从而治疗由细菌引起的感染性疾病,成为开发抗菌治疗的新方式。纳米抗体(nanobody, Nb)通过拮抗细菌黏附、运动以及细菌毒力因子等不同方式对抗细菌感染,减少致病菌黏附,如通过选择能够抑制细菌在上皮细胞粘附的抗表面抗原的VHH,可用于预防菌源性腹泻。此外,纳米抗体(nanobody, Nb)还可以防止细菌或细菌毒素进入细胞,如VHH R303与内化蛋白B (internalin B, Inl B) 上c-Met作用位点结合,能竞争性地抑制李斯特菌入侵赫拉细胞,进一步研究结果表明其可用于治疗和预防李斯特菌病。
作为解毒剂的纳米抗体
在许多国家,蛇、蝎子、蜘蛛等的毒液严重危害人类健康。研究表明,纳米抗体(nanobody, Nb)具有良好的中和能力,Jinkins等成功分离出对α-眼镜蛇毒素(α-Cbtx) 具有很高亲和力的VHHs (C2和C20),它们能够完全中和α-Cbtx的致死作用。Calderon等开发了一套针对黄腭蛇毒出血性和肌毒成分的纳米抗体(nanobody, Nb),通过小鼠实验确定了Nbs H6、H8和H9具有最好的蛇毒出血作用中和活性,Nbs M28、M35、M43、M67、M85和M88可作为较好的肌毒作用抑制剂。Ahmadi等总结了几种蝎子毒液治疗的抗毒剂,与传统抗毒剂相比,纳米抗体因其具有较高的体外稳定性和低的免疫原性,具有发展为下一代蝎子抗毒血清的潜力,如有研究表明anti-HNc纳米抗体(nanobody, Nb)能够对毒蝎的HNc类毒素的侵害提供完全的保护,一种双特异性NbF12-10展现了出色的毒液中和能力,对致命的蝎子蜇伤也能提供全面保护。因此,未来纳米抗体(nanobody, Nb)可作为解毒剂以提供安全有效的治疗方法。
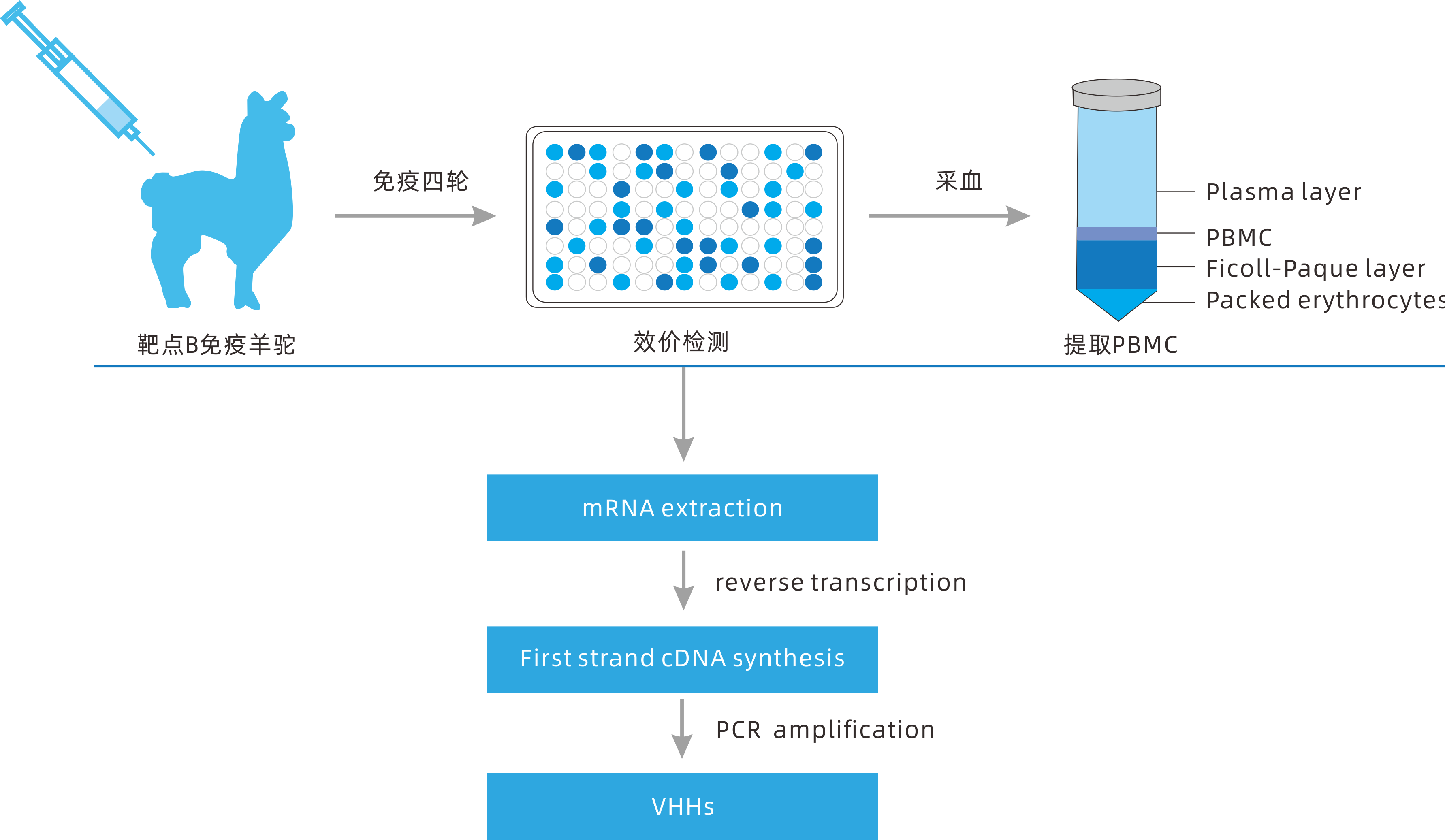
普健生物拥有自建养殖基地,每年近百头成年羊驼用于免疫,稳定提供大量的免疫抗原。拥有近千亿级别天然库,最快在2周内可完成针对各类靶点的特异性纳米抗体快速筛选,抗体亲和力可达10-9M 级别,插入正确率100%,序列正确率97%,随机选取200个克隆测序,均无重复序列;并且免疫库源自百余只不同种类的驼类样本-羊驼(Alpaca )、骆驼(Camel)、美洲驼(Llama),提供更高抗体多样性以构建免疫库,获得更高亲和力VHH序列。
随着研究的不断深入,纳米抗体(nanobody, Nb)优越的特性也将会在更多领域展现其应用价值,其高稳定性或可使其在医学和临床应用中发挥作用,如解决疫苗或抗体药物研发中存在的疗效、安全性、费用等一系列问题及抗生素耐药性的问题,或能实现多途径给药等。我们期待未来纳米抗体(nanobody, Nb)更多引人注目的研究成果的问世。
参考文献:
SUN S, TAN X, PANG XY, LI M, HAO XJ. Recent advances in the application of nanobody technology: a review. Chinese Journal of Biotechnology, 2022, 38(3): 855-867.

 联系我们
联系我们





