自噬促进B细胞的代谢稳态,特别是外周激活和记忆细胞维持。它还与抗原呈递和自身免疫检查点缺失有关。这引起了人们对自噬在扩展SLE、RA和多发性硬化(MS)等疾病中自身反应性B细胞的功能和生存方面可能发挥的作用的极大兴趣。虽然不是细胞特异性的,但自身免疫中自噬紊乱的早期证据来自全基因组关联研究(GWAS)。
虽然GWAS不能以细胞特异性的方式解决关联,但随后的研究表明,与健康对照相比,SLE患者的B细胞显示出较高的Atg5表达。此外,在Prdm1-Atg5基因间区域的一个SLE相关SNP与SLE患者和健康个体的B细胞中自噬相关基因的表达升高相关。B细胞自噬和自身免疫之间的明显关联似乎是由几种不同的机制介导,这些机制可能以疾病特异性的方式发生。
与代谢一样,自噬失调与自身免疫的耐受性检查点功能丧失相关。虽然自噬对于B2细胞发育是必不可少的,但这并不排除自噬改变在使自身反应性B细胞前体破坏代谢或凋亡检查点方面发挥作用。事实上,与健康对照相比,自噬在狼疮易感小鼠中上调,但这种差异仅限于骨髓中存在的前B细胞、未成熟和成熟B细胞。脾脏B细胞(包括pc)之间无差异。在SLE患者中,与健康对照相比,自噬水平升高的naïve B细胞比pc或记忆细胞更显著。前B细胞和naïve B细胞都受耐受性检查点的影响。上调的自噬可能保护自身反应性B细胞免受凋亡或代谢损伤刺激。
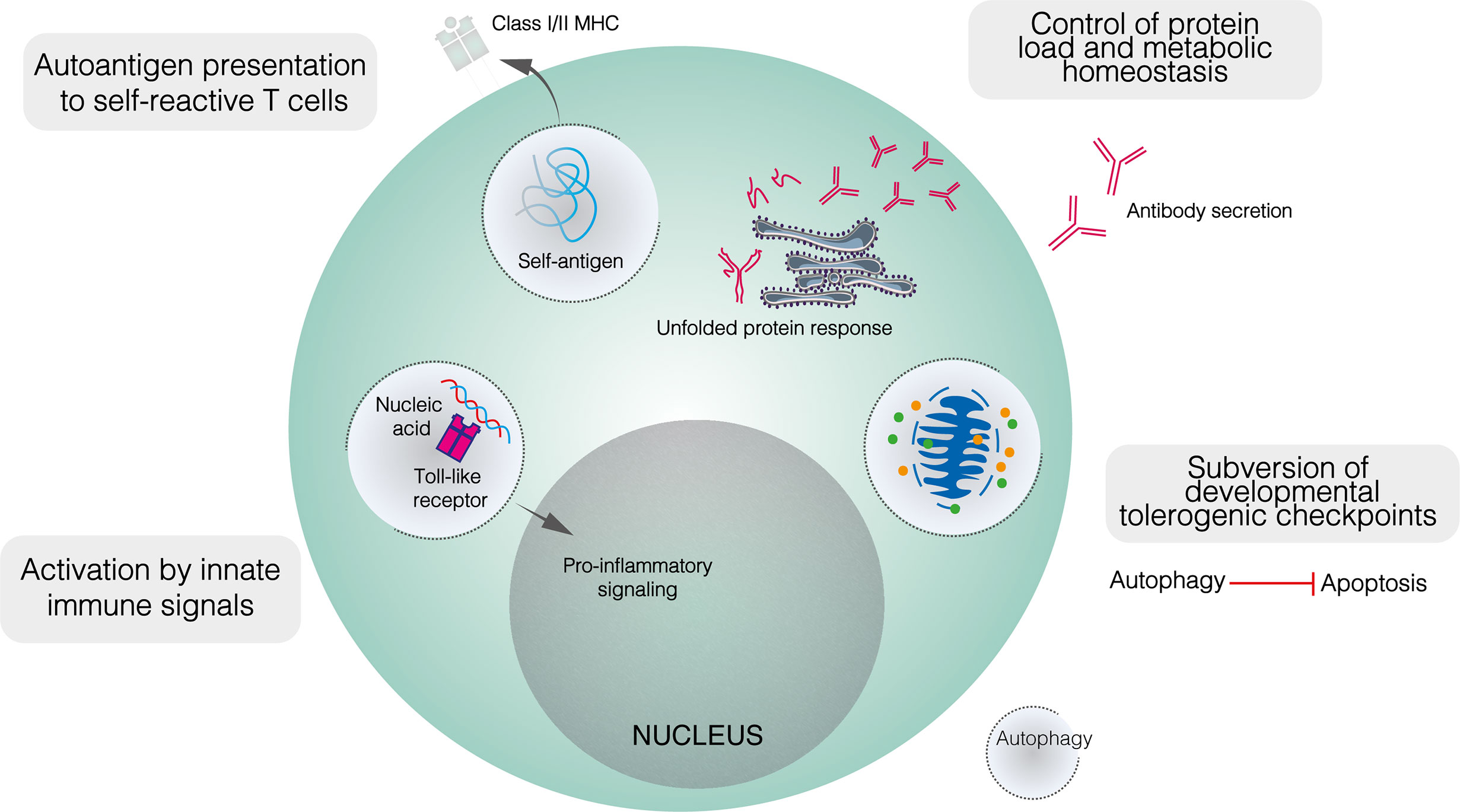
自噬似乎也在使B细胞能够加工和呈递来自自身抗原的肽,使其与T细胞同源的过程中发挥作用。生理学上,自噬已被证明介导了来自特定抗原的肽的呈递。在自身免疫中,自噬使B细胞能够在MHC-II上呈递瓜氨酸化肽,针对瓜氨酸化抗原的抗体在自身免疫疾病中具有显著特征,尤其是在RA中。在体外,B淋巴瘤细胞通过血清饥饿(一种激活自噬的状态)来提呈内源性瓜氨酸肽,并被III类PI3K抑制剂3-MA和Atg5敲低抑制。此外,用抗IgM抗体刺激原代B细胞可诱导显著的瓜氨酸肽提呈和LC3-II水平升高。鉴于抗Ig抗体在RA中的出现频率以及与BCR接触后明显诱导自噬,有人提出这些抗体可触发MHC-II上内源性瓜氨酸化抗原的呈递。虽然自噬和RA之间的确切关系尚不清楚,但与健康对照相比,RA患者的B细胞自噬体密度并未上调,但自噬活性似乎是某些自身抗原呈递所必需的。
B细胞自噬也与MS中向细胞毒性T淋巴细胞呈递瓜氨酸化自身抗原相关。EBV是MS发生的已知危险因素,可诱导B细胞的自噬,并且最近发现EBV与髓鞘少突胶质细胞糖蛋白(MOG)来源肽的I类MHC (MHC - I)呈递相关。自噬在这一过程中的作用尚不明确,但自噬小体可能保护瓜氨酸化的MOG肽免受组织蛋白酶介导的降解,从而使它们朝向MHC-I交叉呈递机制。
除了BCR配体外,自噬还与B细胞通过tlr7和9识别固有免疫触发物(特别是核酸抗原)有关。这些受体分别识别病原体来源的ssRNA和含CPG的双链DNA,它们的细胞表达仅限于核内体,以防止自身核酸的交叉识别。对自身核酸的识别可能直接激活B细胞或使其对BCR介导的激活敏感:Tlr7或Tlr9的转基因过表达产生自身反应性PC,并在小鼠中触发狼疮样疾病。转基因Tlr7过表达诱导的小鼠实验性狼疮在B细胞自噬缺失的情况下得到改善。自噬介导了树突状细胞内吞的含RNA的免疫复合物转运到含tlr7的胞内体,并且可能在B细胞中发挥类似的作用。
自噬也与TLR9信号传导有关。在BCR结合后,包含tlr9的内体被募集到包含内化BCR -抗原复合物的自噬体中,尽管这种共定位被3-MA消除。与单用抗IgM相比,与CpG DNA结合的抗IgM超激活B细胞,当通过破坏微管功能来阻断TLR9募集到自噬体时,这种叠加效应被消除。因此,自噬似乎在将核酸抗原传递给核内体TLRs中起着重要作用,可能会损害对自身和非自身核酸的区分。
直观地看,自噬在维持PC活力方面的作用应该可以扩展到自我反应性PC。虽然与健康对照相比,狼疮小鼠的PC自噬水平没有明显上调,但它在小鼠实验性狼疮的病理过程中发挥了重要作用。在成熟B细胞中有条件缺失Atg5的小鼠中,抗dsDNA IgM水平与野生型小鼠相似,而抗dsDNA IgG水平显著较低。脾脏B细胞库,包括不同B细胞亚群的比例和生发中心的出现,在很大程度上不受自噬缺失的影响,尽管骨髓LLPCs被清除。总之,这些结果表明,自噬对自身免疫中的早期B细胞活化作用很小,但在确保自身反应性pc的长期生存方面很重要。有人提出,SLPC的存活率可能在缺乏自噬的情况下受到损害,但可以通过增加的补充来补偿。重要的是,自噬缺乏也可能减少记忆B细胞的间隔。
参考文献
Iwan G. A. Raza,B Cell Metabolism and Autophagy in Autoimmunity,Front. Immunol., 07 June 2021,Sec. Autoimmune and Autoinflammatory Disorders,Volume 12 - 2021

 联系我们
联系我们





