单克隆抗体技术是现代生命科学研究的重要工具,其在蛋白质的结构与功能研究、疾病诊断、药效学及临床应用等方面有着不可或缺的作用。近年来,随着分子生物学和细胞生物学的发展,单个B细胞抗体制备技术开始兴起,并逐渐得到广泛应用。单个B细胞抗体技术制备的单克隆抗体所具有的全人源性、自身高度特异性和均一性的特点在治疗病原微生物感染、肿瘤、自身免疫性疾病和器官移植等方面显出了独特的优势和良好的应用前景。
Xten™MabSingleB兔单克隆抗体开发以单个B细胞为起始点,利用每个B细胞只产生一种特异性抗体的特性,直接从免疫的兔子中通过随机分离和抗原特异性分离两种方式从外周血或淋巴组织中分离单B细胞,从单个B细胞中扩增出抗体基因,进而获得抗原特异性抗体。该技术所制备的抗体具有高通量、高效率、高稳定性、高特异性等优点,保留了丰富的基因多样性和轻重链可变区的天然配对,应用前景广泛,是最高效的抗体筛选方法之一。特别是在快速应对病原微生物传染病的抗体开发上有着巨大优势。基于单个B细胞技术的Xten™MabSingleB兔单克隆抗体开发有三个主要流程,鉴定和分离单个B细胞;扩增和克隆抗体基因;表达、筛选和鉴定抗原特异性抗体。
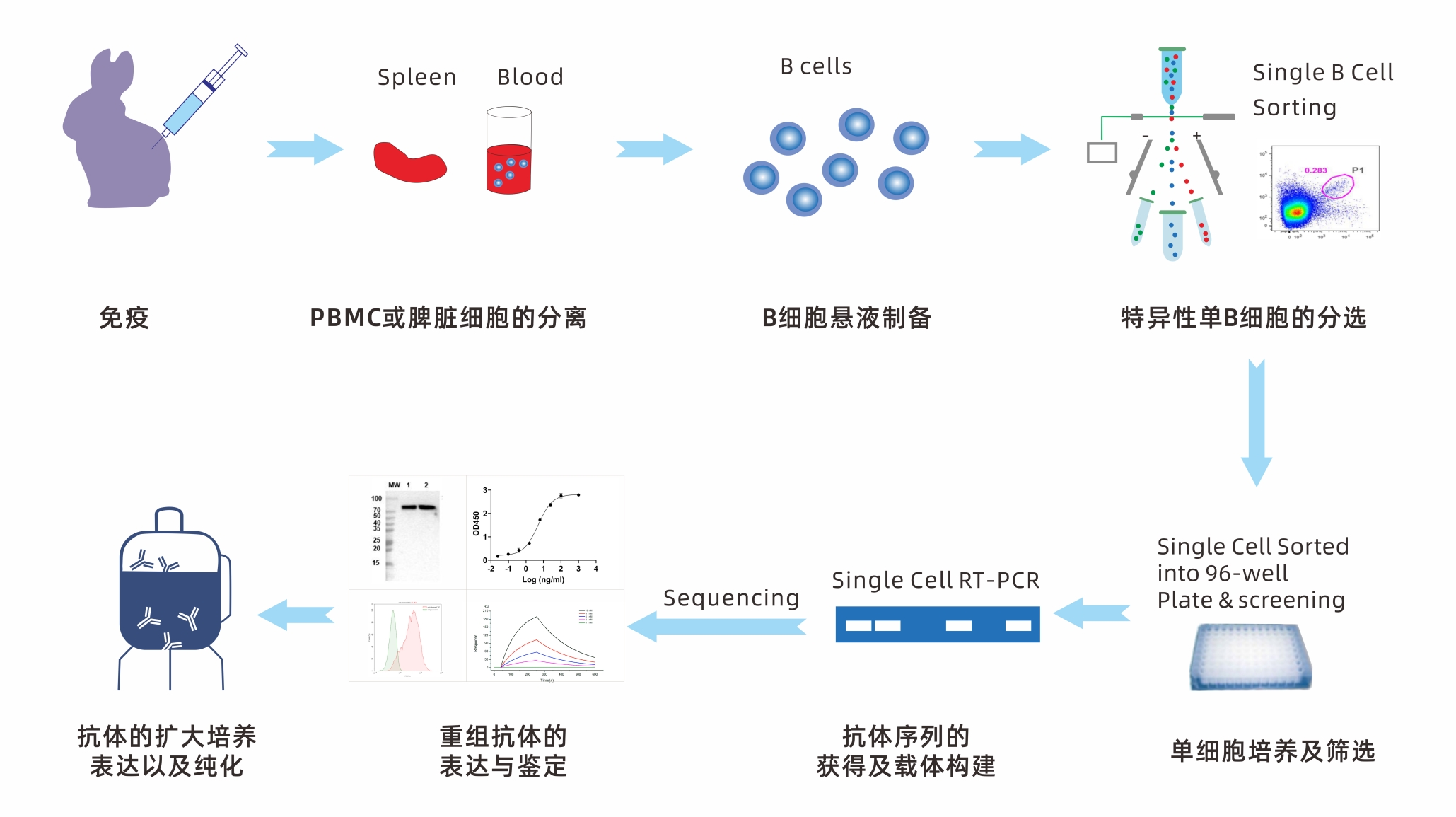
鉴定和分离单个B细胞
目前普遍运用于抗原特异性单个B细胞分离的方法包括:荧光标记抗原多参数细胞分选法
(Fluorochrome-labeledantigensviamultiparameter,FACS)、抗原标记磁珠分选法(Antigencoatedmagneticbeads)、微雕法(Microengraving)以及细胞微阵列芯片法(Cell-basedmicro-arraychipsystems)。
荧光标记抗原多参数细胞分选法与荧光激活细胞分选法类似,二者差异在于前者在加入用于标记B细胞表面抗原的荧光抗体之外,还需加入荧光标记的目标抗原用来结合B细胞表面的膜抗体,以分选目标抗原特异性的B细胞。它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,此技术不仅提高分离细胞的纯度,而且可以得到更多的细胞信息,分选各个时期的B细胞用于不同的研究方向。该方法具有速度快、精度高、自动化程度高等优点,已成为当代最先进的细胞定量分析分选技术。
抗原标记磁珠分选法基本原理是基于细胞表面目标抗原特异性抗体能与连接有磁珠的目标抗原相结合,在外加磁场中,通过目标抗原与磁珠相连的细胞被吸附而滞留在磁场中,无该种表面特异性抗体的细胞由于不能与连接着磁珠的目标抗原结合而没有磁性,不在磁场中停留,从而使细胞得以分离。这种方法可以在几分钟内从复杂的细胞混合物中分离出高纯度的细胞,在流式分选单细胞前可用磁珠分选法进行预分离,但是由于磁珠影响细胞生物活性因而不利于分离后培养与操作。
微雕法基于软光刻(Softlithographic)微阵列芯片识别、恢复和克隆产生抗原特异性抗体的B细胞,刺激多克隆B细胞产生抗体并将其逐个置于芯片孔内,将该芯片转印至相应的蛋白芯片后,即可用荧光标记的目标抗原识别特异性抗体,进而显微操作将检测到的分泌目标抗原特异性抗体B细胞转移到细胞培养皿中进行后续克隆操作。
微阵列芯片法同微雕法具有高通量(每个芯片分选细胞量高达10万个细胞)、快速、成本低、可直接从多克隆B细胞中分选并鉴定抗体分泌B细胞等优点。酶联免疫斑点微阵列芯片法(Immunospotarrayassayonachip,ISAAC)是微阵列芯片法的延伸和补充,该方法用包被于芯片表面的抗免疫球蛋白抗体来代替微雕法转印蛋白芯片的过程,抗免疫球蛋白抗体能够快速捕捉抗体分泌B细胞分泌的抗体,进而用生物素标记的目标抗原识别特异性抗体,从而达到筛选并分离特异性抗体分泌B细胞的目的。ISAAC法较微雕法另一改进在于,前者能在同一块芯片上筛选针对多种不同目标抗原的特异性抗体,简化了实验过程且更加高效,是目前前景非常广阔的分选B细胞方法。

扩增和克隆抗体基因
经典克隆未知抗体基因的方法(如cDNA文库筛选等)有着共同的缺点——操作繁琐、周期较长、工作量大。近些年随着PCR技术的快速兴起和成熟,单个B细胞抗体基因的扩增和克隆也随之发展。
细胞分选时,通常需将单个B细胞分至内含适量细胞裂解液、RNA酶抑制剂和PCR反应试剂的适当容器中,如96孔板。由于单个细胞内RNA含量少,适当的容器可以方便大批量操作防止样品损失或交叉污染。另外,不同类型B细胞抗体分泌能力差异明显,如抗体分泌B细胞中抗体基因转录本含量远高于记忆B细胞,因此从抗体分泌B细胞中更容易扩增得到抗体基因。
通常从单个B细胞中扩增未知抗体基因,需使用合适的引物进行巢式或半巢式逆转录PCR(Nestedorsemi-nestedRT-PCR),该过程要求引物具有通用性、灵敏性、特异性,能避免非特异性扩增又能扩增出完整的抗体基因序列,因此合理设计引物序列至关重要。通常针对抗体重链轻链可变区不同前导序列设计前向引物的混合物,反向引物特异性互补于抗体恒定区。根据实验目的,如果分离和扩增不同同种型的抗体,反向弓物则是特异性互补于各种同种型抗体恒定区的混合物。除此之外,为方便重叠延伸PCR重组和酶切克隆抗体重链轻链可变区基因,前向引物5端和反向引物3端需要包含限制性内切酶位点。
表达、筛选和鉴定抗原特异性抗体
鉴定抗体的抗原特异性和生物活性前需将携带有抗体基因的表达载体在相应系统中表达,最简单常用的是原核表达系统,如Escherichiacoli,相较而言,真核表达系统尤其是哺乳动物细胞表达系统更有利于抗体的加工修饰,其产物的生物活性可靠性更高,常用的有HEK293和CHO等细胞系。通过亲和层析和离子交换层析纯化到的抗体,可通过SDS-PAGE,Westernblotting,ELISA等常规方法筛选和鉴定抗体,也可通过免疫沉淀(Immunoprecipitation)、空斑法(Plaqueassay)、空斑减少中和测定法(PRNT50assay)、流式分析法(FACSanalysis)、活细胞成像测定法(Livecellimagingassays)、体内药物活性测定法等方法进一步测定抗体与抗原的特异性、亲和力以及中和活性保护活性等生物学特性。
在过去的40年里,随着单克隆抗体在各个领域的研究和应用日趋广泛。而近10年来,随着基于单细胞的抗体制备相关技术的开发和完善,单个B淋巴细胞抗体制备技术已逐渐成为单克隆抗体制备的主要技术。单个B淋巴细胞抗体制备技术作为未来单克隆抗体制备的主流技术,各阶段的方法和环节都存在着极大的进展空间,所制备的单克隆抗体也具有无限的开发和应用前景。
参考文献
ChiXY,YuCM,ChenW.SingleBcellmonoclonalantibodytechnologiesandapplications.ChinJBiotech,2012,28(6):651−660.

 联系我们
联系我们





