1993年比利时科学家Hamers在骆驼体内发现了天然重链抗体,其重链可变区VHH(the variable domains of the heavy chain of heavy chain only antibodies)能够克服传统全长抗体组织穿透性差、免疫原性强等缺陷。VHH即纳米抗体(Nanobody,Nb)具有高亲和力、特异性强、分子量小、低免疫原性和高水溶性等特点。然而靶向单一抗原可能会由于免疫逃逸等难以满足疗效。
双特异性纳米抗体(bispecific nanobody, BsNb)能够同时识别两种不同的抗原或者表位,相比于纳米抗体具有更强的特异性、靶向性和更低的脱靶毒性,在治疗中体现出双靶点信号阻断、降低免疫逃逸与耐药性的优势。通过基因工程对纳米抗体进行双特异性抗体设计,再借助计算机模拟进行体外亲和力成熟从而获得高亲和力抗体序列。双特异性纳米抗体靶标结合力的增强和血清半衰期的延长可使其效能得到提高,在感染、肿瘤及免疫领域诊断与治疗中已成为研究热点。
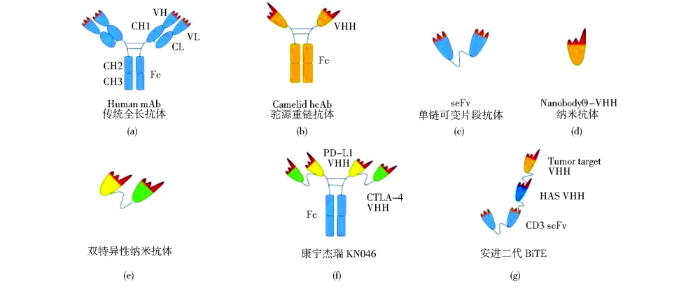
纳米抗体的CDR3区增长并具有“凸形”结构,作为抗原识别位点可抑制载脂蛋白L-1 酶活性杀灭锥体虫,治疗非洲锥虫病。根据其高稳定性特点,Ren等制备出识别特定肽标记的纳米抗体,用于亲和层析技术而提升蛋白质纯化效率,为高效纯化提出新的策略。纳米抗体表面亲水不与轻链结合而易聚合,利用基因工程可将两种针对肿瘤不同靶标的纳米单体构建出双特异性抗体用于提升抗肿瘤抗体的特异性。安进设计出用连接肽将纳米抗体与重链抗体的N端遗传融合的双特异性重链抗体BiTE,可同时与T细胞和病变细胞结合,增强T细胞杀伤作用特异性。
尽管单价纳米抗体分子量小对穿透组织有利,但也使其在血清中的半衰期较短导致易被快速清除而难以发挥疗效。纳米抗体与白蛋白融合或多聚纳米抗体可延长其血清半衰期以改善其药代动力学特征,在类风湿性关节炎等疾病的治疗中有着潜在的应用价值。例如,白蛋白结合双特异性纳米抗体构建的ALX-0061和ATN-103(Ozoralizumab),可以分别靶向白介素-6(IL-6)和肿瘤坏死因子α(TNF-α)从而达到疗治类风湿关节炎的目的。
参考文献
YUAN Bo,WANG Jie-wen,KANG Guang-bo,HUANG He. Research Progress and Application of Bispecific Nanobody. China Biotechnology, 2021, 41(2/3): 78-88.

 联系我们
联系我们





