写在前面:
胶原蛋白是哺乳动物中含量最多的蛋白质,至今已发现28种类型,主要分为纤维性胶原蛋白、网状胶原蛋白、珠状丝状胶原蛋白、锚定纤维蛋白、膜蛋白以及multiplexins胶原蛋白,其中纤维性胶原蛋白中Ⅰ型、Ⅱ型、Ⅲ型胶原蛋白占人体胶原蛋白的80%~90%。
胶原蛋白是人体细胞外基质的主要蛋白质,在人体中含量丰富,占人体蛋白质三分之一,占皮肤干重四分之三,对于骨骼、皮肤、关节起关键的连接作用。除了结构上的作用外,胶原蛋白还可以与各种大分子如整合素、装饰蛋白、纤维连接蛋白、肝素和基质金属蛋白酶(MMP)发生相互作用,在调节组织再生过程中十分重要。
作为哺乳动物含量最丰富的蛋白质,胶原蛋白为哺乳动物组织提供主要的结构与机械支持,是一种结构特殊、功能多样的蛋白质,基于其开发的产品已经广泛应用于生物医药、化妆品、皮革、生物科技等行业。胶原蛋白作为一种生物聚合物,还可以与其他亲水性聚合物混合形成高质量水凝胶和可生物降解的支架,其中胶原蛋白与壳聚糖共混物的制备已经成为科学界重点关注的课题。目前,根据来源,胶原蛋白大致分为动物源胶原蛋白和重组胶原蛋白。动物源胶原蛋白主要来源于陆生动物以及海洋动物,而重组胶原蛋白是指将人胶原蛋白基因克隆到选定的表达载体并转化到表达细胞内,最后通过纯化技术所获得的蛋白质。
胶原蛋白是含有三螺旋结构的纤维状胶原蛋白,约占蛋白总质量的三分之一,其中哺乳动物中胶原蛋白含量最高的是肌腱(80%),其次是皮肤(70%)、骨骼(25%)以及主动脉(20%)。胶原蛋白的基本组成单位是由3条α链组成的原胶原。正是由于原胶原分子中3个平行α链以一个接一个残基交错形成的聚脯氨酸Ⅱ型(PPⅡ)左手螺旋构象决定了胶原蛋白结构。拥有正确折叠的三螺旋结构对于胶原蛋白在细胞外基质实现细胞与细胞之间相互作用至关重要。在三螺旋结构中每一个α链都由重复肽三联体(Gly-Xaa-Yaa)组成,其中Xaa和Yaa通常是脯氨酸和羟脯氨酸。由于高度螺旋化,三联体中的3个氨基酸残基在螺旋内部占据不同的位置。其中,甘氨酸残基埋藏在中心,溶剂不容易进入;Xaa位置的氨基酸残基高度暴露于溶剂中;Yaa位置由于靠近相邻链,因此被溶剂接触的可能性较低。对Gly-Xaa-Yaa的大量研究揭示了影响胶原蛋白三螺旋结构稳定的多重因素,这些因素包括3条链条的紧密包装、链之间形成的氢键、广泛的水合网络以及高含量的脯氨酸和羟脯氨酸形成。
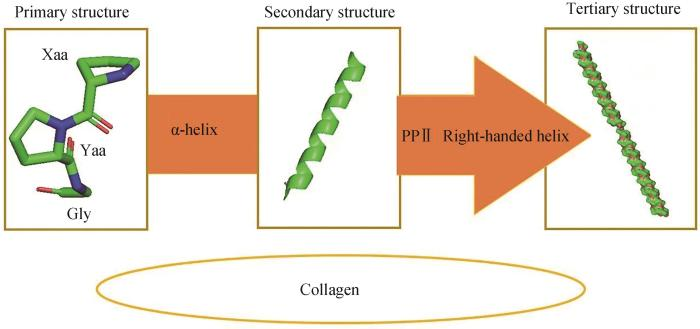
(胶原蛋白一级结构展示了胶原蛋白主要由脯氨酸、甘氨酸以及羟脯氨酸等氨基酸构成;二级结构则展示了脯氨酸、甘氨酸以及羟脯氨酸等氨基酸通过α螺旋使胶原蛋白二级结构趋于稳定;三级结构展示了3条α链经过左手螺旋构象形成原胶原)
胶原蛋白作为最丰富的动物蛋白,至今已发现28种类型,而根据胶原蛋白所形成具有不同活性的形态结构可将胶原蛋白类型大致分为纤维性胶原蛋白与非纤维性胶原蛋白。纤维性胶原蛋白中Ⅰ型、Ⅱ型、Ⅲ型胶原蛋白占人体胶原蛋白的80%~90%。Ⅰ型胶原蛋白作为人体中最常见的胶原蛋白,主要分布在皮肤、肌腱和骨骼中,Ⅱ型主要分布在软骨中,Ⅲ型主要分布在皮肤和血管系统中。
胶原蛋白类型、分布及功能
| 类型 | 组成 | 分布 | 功能 |
| Ⅰ | α1[Ⅰ]2α2[Ⅰ] | 真皮、骨骼、肌腱、韧带 | 其变异会造成骨质疏松、牙齿异常、蓝色巩膜、皮肤薄、肌腱无力、听力丧失 |
| Ⅱ | α1[Ⅱ]3 | 软骨、玻璃体 | 与骨形态形成蛋白-2和转化因子P结合,有利于软骨的发育 |
| Ⅲ | α1[Ⅲ]3 | 皮肤、血管、肠 | 其突变会造成埃勒-丹洛斯综合征 |
| Ⅳ | α1[Ⅳ]2α2[Ⅳ] α3[Ⅳ]α4[Ⅳ] α5[Ⅳ]α5[Ⅳ]2α6[Ⅳ] |
基底膜 | 作为细胞和组织的支撑结构,细胞选择型过滤器,抑制血管生成与肿瘤生长 |
| Ⅴ | α1[Ⅴ]3 α1[Ⅴ]2α2[Ⅴ] α1[Ⅴ]α2[Ⅴ]α3[Ⅴ] |
骨、真皮、角膜、胎盘 | 神经发育与再生,其突变会造成埃勒-丹洛斯综合征 |
| Ⅵ | α1[Ⅵ]α2[Ⅵ] α3[Ⅵ] α1[Ⅵ]α2[Ⅵ] α4[Ⅵ] |
骨头、软骨、角膜、真皮层 | 作为细胞和组织的支撑结构,细胞选择型过滤器,肌功能主要贡献值 |
| Ⅶ | α1[Ⅶ]2α2[Ⅶ] | 真皮、膀胱 | 其突变会造成大疱性表皮松解症 |
| Ⅷ | α1[Ⅷ]3 α2[Ⅷ]3 α1[Ⅷ]2α2[Ⅷ] |
真皮、大脑、心脏、肾脏 | 作为细胞和组织的支撑结构、细胞选择型过滤器 |
| Ⅸ | α1[Ⅸ]α2[Ⅸ]α3[Ⅸ] | 软骨、角膜、玻璃体 | 参与细胞外基质的完整性和稳定性,调节胶原蛋白形成过程 |
| Ⅹ | α1[Ⅹ]3 | 软骨 | 作为细胞和组织的支撑结构,细胞选择型过滤器,有利于软骨发育 |
| Ⅺ | α1[Ⅺ]α2[Ⅺ]α3[Ⅺ] | 软骨、椎间盘 | 有利于软骨发育 |
| Ⅻ | α1[Ⅻ]3 | 真皮、肌腱 | 参与细胞外基质的完整性和稳定性,调节胶原蛋白形成过程,维持组织的完整性与机械性 |
| ⅩⅢ | α1[ⅩⅢ]3 | 内皮细胞、真皮、心脏、眼睛 | — |
| ⅩⅣ | α1[ⅩⅣ]3 | 骨、真皮、软骨 | 参与细胞外基质的完整性和稳定性,调节胶原蛋白形成过程,维持组织的完整性与机械性 |
| ⅩⅤ | α1[ⅩⅤ]3 | 毛细血管、肾脏、睾丸、心脏 | 抑制血管生成与肿瘤生长 |
| ⅩⅥ | α1[ⅩⅥ]3 | 真皮、肾 | 参与细胞外基质的完整性和稳定性,调节胶原蛋白形成过程 |
| ⅩⅦ | α1[ⅩⅦ]3 | 上皮细胞中半脂小体 | 其突变会造成大疱性表皮松解症 |
| ⅩⅧ | α1[ⅩⅧ]3 | 基底膜、肝脏 | 抑制血管生成与肿瘤生长,信息分子受体,维护肾脏形态 |
| ⅩⅨ | α1[ⅩⅨ]3 | 基底膜 | 调节胶原蛋白形成过程 |
| ⅩⅩ | α1[ⅩⅩ]3 | 角膜(小鸡) | 参与细胞外基质的完整性和稳定性,调节胶原蛋白形成过程 |
| ⅩⅪ | α1[ⅩⅪ]3 | 胃、肾 | — |
| ⅩⅫ | α1[ⅩⅫ]3 | 组织连接 | 软骨中结构和功能分离的基质聚集体,与软骨纤维外基质结合 |
| ⅩⅩⅢ | α1[ⅩⅩⅢ]3 | 心、视网膜 | 增殖区组织所必需,细胞外基质关键的结构作用 |
| ⅩⅩⅣ | α1[ⅩⅩⅣ]3 | 骨头、角膜 | — |
| ⅩⅩⅤ | α1[ⅩⅩⅤ]3 | 大脑、心脏、睾丸 | — |
| ⅩⅩⅥ | α1[ⅩⅩⅥ]3 | 睾丸、卵巢 | — |
| ⅩⅩⅦ | α1[ⅩⅩⅦ]3 | 软骨 | — |
| ⅩⅩⅧ | α1[ⅩⅩⅧ]3 | 真皮、坐骨神经 | — |
胶原蛋白的形成始于胶原蛋白编码基因通过转录、翻译等作用形成新生胶原蛋白α链(称为前α链),胶原蛋白前α链在内质网中先后经历脯氨酸-4-羟化酶(P4H)与赖氨酸羟化酶(LH)的修饰作用,使Gly-Xaa-Yaa中Yaa位上的脯氨酸残基与赖氨酸残基分别羟基化,而一部分羟基化赖氨酸残基则进一步糖基化。脯氨酸羟基化和赖氨酸羟基化分别是实现三螺旋结构的稳定性和细胞外成熟胶原交联的必需步骤。若新生胶原蛋白α链羟基化出现畸形,形成的不良胶原蛋白三螺旋结构将在细胞内堆积,导致蛋白质折叠和内质网应激反应。除了P4H与LH作用外,前胶原蛋白α链还需要脯氨酸-3-羟化酶(P3H)进行修饰。随后,3条胶原蛋白前α链的C端前肽在内质网膜凝集素样分子伴侣、钙联蛋白和内质网氧化还原酶PDI的协同作用下形成的二硫键,并将胶原蛋白α单链三聚体化,形成三螺旋构象,这种构象从C端一直持续到N端。同时,胶原蛋白特异性分子伴侣HSP47与三螺旋前胶原蛋白相互作用,防止前胶原蛋白局部展开和聚集。经胶原蛋白特异性分子伴侣HSP47作用后,前胶原蛋白被内质网出口TANGO1识别,运输到高尔基体中。在高尔基体中,HSP47从前胶原蛋白解离,并通过KDEL(REDL)受体返回内质网中。同时,高尔基体将前胶原蛋白运送分泌到细胞外基质,通过N端酶与C端酶的共同作用将前胶原蛋白多余N端与C端前肽进行切除,形成完整的胶原蛋白分子。
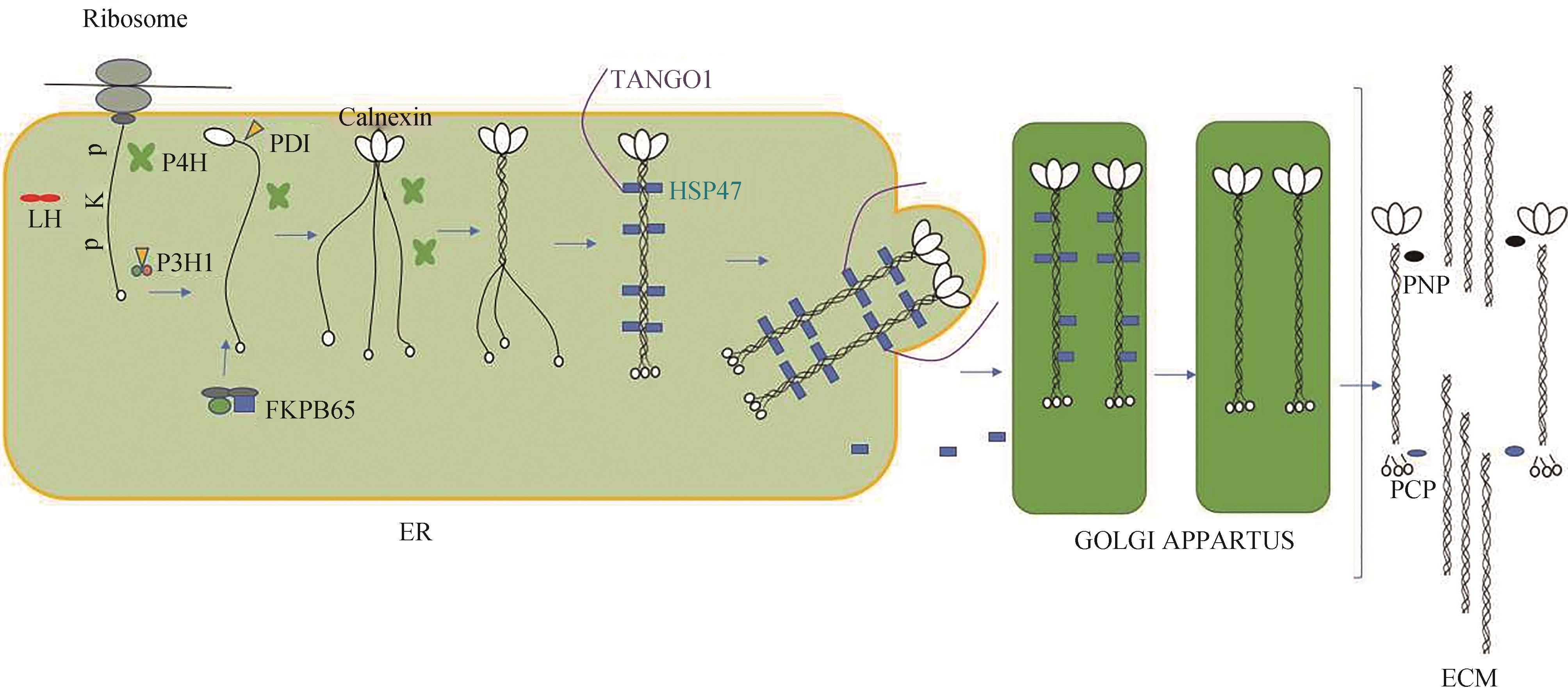
胶原蛋白合成机制图
重组胶原蛋白的表达体系主要包括原核生物(主要为大肠杆菌)、酵母、植物、杆状病毒、哺乳动物细胞表达体系。现阶段表达体系中以大肠杆菌、酵母为主,但高效的大肠杆菌、酵母等表达体系缺乏动物细胞中胶原蛋白翻译后修饰,需要添加相对应的重组酶。而植物、杆状病毒、哺乳动物细胞表达体系所产生胶原蛋白含量虽然远低于大肠杆菌、酵母体系,但具有完整的三螺旋结构和较好的热稳定性。不同重组胶原蛋白表达体系表达胶原蛋白所需成本仍有比较大的区别,植物表达体系因其具备光合作用自生产能力,其表达胶原蛋白成本相对较低;大肠杆菌以及酵母虽然具备一定发酵成本,但由于其表达产量较高,表达单位胶原蛋白所需成本也较低,但表达的胶原蛋白缺乏羟基化及相应活性;昆虫杆状病毒表达体系由于其表达量少,生产周期长,因此其表达单位胶原蛋白成本较高;哺乳动物细胞表达体系属于高级重组表达体系,由于其表达体系复杂,培养要求高,因此其表达单位胶原蛋白的成本也较高。
| 重组胶原蛋白表达体系 | 成本 | 优点 | 缺点 |
| 植物表达体系 | 较低 | 可规模化,生产周期短,成本低,安全性高 | 产量较低,产能不足 |
| 大肠杆菌表达体系 | 较低 | 遗传背景清晰,发酵成本较低,生产周期短,效率高 | 产生胶原蛋白缺乏羟基化 |
| 酵母表达体系 | 较低 | 较高的安全性,发酵成本较低,产量高 | 多为同源性胶原蛋白,生产异源性胶原蛋白较为困难 |
| 昆虫杆状病毒表达体系 | 较高 | 背景干扰低,进行翻译后处理能力更强 | 周期较长、产量较低 |
| 哺乳动物细胞表达体系 | 较高 | 表达稳定,产量稳定 | 表达周期长,成本高,有病毒感染风险 |
重组胶原蛋白相较于传统动物提取胶原蛋白,具有更高亲水性、更高生物活性区域、更优异的抗氧化性能以及止血与促伤口愈合能力。重组胶原蛋白自研发以来,在生物医药工程中得到广泛的应用。
在皮肤修复上,Zhao等发明的MTGase交联重组类人胶原蛋白水凝胶具有良好的生物相容性,在动物实验中也证实该材料具备较低的毒性,有望作为水凝胶材料修复皮肤损伤。Pan等通过反复冻融聚乙烯醇、重组人类胶原蛋白与羧甲基壳聚糖的混合液得到水凝胶敷料,该敷料与商业敷料相比,能显著促进全层皮肤伤口愈合,显示了其作为皮肤创面愈合创面敷料的巨大潜力。Woodly等通过获得重组人Ⅶ型胶原蛋白,将其迁移到隐性营养不良大疱性表皮松解症患者的真皮-表皮交界处,有效预防皮肤起泡与糜烂的形成;Dong等在近年来证实将重组类人胶原蛋白与重组类人纤连蛋白联合治疗C57BL/6小鼠的急性伤口的效果高于两者单独治疗效果,为重组胶原在皮肤治疗修复方面开辟了崭新道路。McLaughlin等通过将重组人Ⅰ型胶原蛋白与重组人Ⅲ型胶原蛋白制成可注射生物材料,将二者注入到心肌梗死增殖后期的小鼠身上,发现使用重组人Ⅰ型胶原蛋作为注射材料可以有效促进愈合环境、心肌细胞存活以及减少心肌病理性重塑,有利于实现心肌梗死后重塑。
在眼科疾病上,Fagerholm等利用重组胶原蛋白植入10名圆锥角膜或角膜瘢痕患者,结果发现,所有患者泪膜得到恢复,基质细胞被招募到植入物中。还观察到患者神经再生和触摸敏感性恢复,与人类供体组织相比,两者都达到更高的程度。通过进一步优化,生物合成角膜植入物可以提供一种安全有效的替代人体组织植入的方法,帮助解决目前供体角膜短缺的问题。随后两年,Fagerholm团队开发了一种由碳二亚胺交联重组人胶原蛋白组成的无细胞植入物,通过植入眼角膜细胞实现了角膜再生,在4年多的时间里,再生的新角膜稳定整合在一起,无排斥反应,也没有发生供体角膜患者所需的长期免疫抑制机制。实验证明,由碳二亚胺交联重组人胶原蛋白组成的无细胞植入物可以实现角膜的再生。因此,重组人胶原蛋白可作为良好的角膜修复植入物。
目前,重组胶原蛋白由于具有较好的生物相容性、更高的安全性以及对皮肤保湿修复明显的特点,在胶原蛋白家族中占有重要地位。随着分子生物学、蛋白质工程等的学科发展,重组胶原蛋白的研究将进一步深入,最终为生物医药领域提供更优质、更安全、更廉价的重组胶原蛋白原料。
参考文献:
PAN Jiahao, PAN Weisong, QIU Jian, XIE Donling, ZOU Qi, WU Chuan. Research progress on recombinant collagen expression system. Synthetic Biology Journal[J], 2023, 4(4): 808-823 doi:10.12211/2096-8280.2023-020

 联系我们
联系我们





